La dehiscencia del canal semicircular superior (DCSS) se trata de una alteración cocleovestibular debido a un defecto óseo en la cápsula ótica. Fue descrita por Minor en 1998 en pacientes que presentaban vértigo inducido por ruido y presión y que, a su vez, mostraban una dehiscencia ósea del hueso que recubre el canal semicircular superior en la Tomografía Computarizada (TC). (1)
En condiciones normales el oído interno presenta dos ventanas, la ventana oval y la redonda, ambas cerradas elásticamente. Los estímulos sonoros estimulan únicamente el caracol del oído interno, induciendo respuestas auditivas. Sin embargo, cuando existe DCSS se crea una "tercera ventana" en el laberinto, lo que resulta en la transferencia de energía mecánica desde la ventana redonda hacia la tercera ventana. Esta disminución de fuerza mecánica a lo largo de la membrana basilar conduce a una disminución de la percepción auditiva en la vía aérea.
A su vez, la energía sonora que se transmite hacia el canal semicircular superior provoca un movimiento de la endolinfa que produce una deflexión ampulífuga (excitatoria) de la cúpula que se traduce en una descarga del nervio vestibular aferente que inerva el CSS, desencadenando un nistagmo vertical-rotatorio con la fase componente lenta en dirección superior y alejándose del oído afectado. Esto es lo que se conoce como fenómeno de Tullio. Este fenómeno excitatorio puede producirse también al realizar presión positiva en el conducto auditivo externo o durante las maniobras de Valsalva con nariz ocluida.
Por otro lado, otros estímulos como presión negativa al conducto auditivo externo, maniobra de Valsalva contra glotis cerrada o compresión sobre la vena yugular, producirán una desviación de la cúpula en dirección ampulípeta (inhibitoria) con unos movimientos oculares en la dirección opuesta. Esto es conocido como signo de Hennebert.(2)
La causa primaria de esta dehiscencia sobre el canal superior es aún desconocida. Existen dos teorías principales:
- Teoría congénita: se basa en estudios que muestran mayor incidencia en niños menores de 2 años que en adultos (3). Un estudio demostró la relación que existe entre la aparición de la DCSS el desarrollo embriológico de la arteria subarcuata. Un retraso en la invaginación de la arteria subarcuata hacia la fosa subarcuata retrasa la osificación de la cápsula ótica, lo que explica el riesgo de la DCSS (4).
Además, se ha encontrado mayor prevalencia en pacientes con variantes patológicas del gen CDH23 (cromosoma 10) que codifica la proteína caderina 23, cuya mutación está presente en niños con sordera congénita (síndrome de Usher tipo 1D) (5), así como casos de DCSS con asociación familiar. (6)
- Teoría adquirida: propone que puede estar asociado a incrementos en la presión intracraneal que producen alteración en los puntos más débiles de la base del cráneo, así como en relación a traumatismos craneoencefálicos. A su vez, otros estudios proponen que la incidencia de DCSS aumenta con la edad. (7, 8, 9)
La Dehiscencia del Canal Semicircular Superior (DCSS) es una patología de la que apenas disponemos de cifras exactas respecto a su incidencia. Apoyándonos en la teoría del origen congénito, se cree que es mayor en niños < 2 años debido a que el crecimiento óseo a nivel del CSS se produce en el período comprendido entre los 2 – 8 años. En el estudio realizado por Sugihara et al, la incidencia fue de un 6,5% en < 18 años (3).
La DCSS suele ser bilateral (2,10) o unilateral y con adelgazamiento óseo del CSS contralateral en al menos el 25% de los casos (11).
La prevalencia de la DCSS está infraestimada, en torno al 0,7%, puesto que la mayoría de los pacientes son asintomáticos (12,13). Los síntomas suelen aparecer en la edad adulta (14), sin diferencias entre sexos; y en algunas ocasiones en relación a traumatismos craneales previos, fracturas de hueso temporal, aumentos de presión intracraneal o cirugías de oído medio (15).
La mayoría de los pacientes con DCSS son asintomáticos (12,13) y, en caso de desarrollar síntomas, éstos suelen comenzar en la edad adulta (14).
La DCSS es la más frecuente de las dehiscencias en la cápsula ótica (35%), pero no la única. Así, atendiendo al lugar donde se encuentre la dehiscencia, la sintomatología podrá variar (16).
Clínicamente, la DCSS se suele manifestar por episodios autolimitados de síntomas vestibulares y nistagmo en el plano del canal semicircular superior inducidos por sonidos (96%) (fenómeno de Tullio) o por presión (82%) (signo de Hennebert); debidos a la existencia de una tercera ventana que favorece que la presión ejercida o la energía acústica generada se dirija al laberinto posterior, produciendo corrientes endolinfáticas ampulífugas o ampulípetas a nivel los canales semicirculares superiores (2,11,12, 17). De este modo, presiones positivas generadas a nivel del CAE o maniobras de Valsalva con las fosas nasales ocluidas generarán corrientes excitatorias ampulífugas que dan lugar a un nistagmo torsional y vertical superior. En cambio, presiones negativas a nivel del CAE o maniobras de Valsalva con la glotis cerrada generarán corrientes inhibitorias ampulípetas, produciéndose un nistagmo torsional y vertical inferior (11).
Cuando existe una tercera ventana a consecuencia de una DCSS, parte de la energía acústica se dirige a través de ella y no alcanza la membrana basilar de la cóclea, generando una caída de la conducción aérea. Al mismo tiempo, se produce una disminución anormal de la impedancia para la conducción de los sonidos al oído interno por vía ósea, produciéndose una “hiperacusia” por esta vía (40%), fundamentalmente con sonidos de baja frecuencia (11,12,17).
Existen otra serie de síntomas que pueden aparecer como acúfeno pulsátil o no pulsátil, autofonía, percepción del sonido producido por los movimientos oculares y el parpadeo, percepción de los sonidos producidos por los movimientos cervicales o las pisadas; así como percepción de crepitación mandibular (2,12).
Respecto al desequilibrio crónico o la sono/fotofobia, no existe una clara evidencia de que estén verdaderamente relacionados con la DCSS (12). También se ha descrito la presencia de nistagmo vertical espontáneo en pacientes con DCSS y aumento de presión intracraneal (13).
Según el documento consenso sobre los criterios diagnósticos de la Sociedad Bárány (12), el diagnóstico de DCSS se realiza cuando el paciente presenta al menos un criterio de cada una de las tres categorías diagnósticas principales (síntomas, test fisiológicos y pruebas de imagen).
- Al menos uno de los SÍNTOMAS presente en la DCSS atribuible como “tercera ventana”:
- Hiperacusia en la vía ósea.
- Vértigo inducido por el sonido y/o oscilopsia que dura mientras se produce el estímulo.
- Vértigo inducido por la presión y/o oscilopsia que dura mientras se produce el estímulo.
- Acúfeno pulsátil.
- Al menos uno de los SIGNOS o test fisiológicos presentes en la “tercera ventana” por transmisión de presión:
- Movimientos oculares (nistagmo) en el plano del CSS cuando se aplica presión/ sonido en el oído afectado o durante la maniobra de Valsalva.
- Umbral de vía ósea negativo en frecuencias graves en la audiometría tonal.
- Umbral disminuido en los potenciales evocados vestibulares miogénicos cervicales (cVEMPS) o aumento de la amplitud en los potenciales evocados vestibulares miogénicos oculares (oVEMPS).
- Imagen compatible con DCSS en la TOMOGRAFÍA COMPUTARIZADA (TC) de alta resolución en la reconstrucción multiplanar en el plano del CSS (Pöschl).
- No atribuible a otro trastorno.
- Pruebas Audiológicas:
La audiometría tonal liminar muestra un gap de 10-15dbs en las frecuencias bajas (250-500Hz), que va disminuyendo hacia las frecuencias agudas (2000-4000Hz). Si el paciente no presenta hipoacusia neurosensorial asociada, puede encontrarse una vía ósea por debajo de 0dBs. Este gap es debido a que el sáculo es más sensible a bajas frecuencias y vibraciones y si la dehiscencia se produce en la región vestibular, la onda de sonido se transmite directamente al nervio vestibular al estimular al sáculo, y la energía acústica se desviará del órgano de Corti, produciendo hipoacusia de transmisión en frecuencias graves. En cambio, a frecuencias elevadas, la sensibilidad del aparato vestibular disminuye y el gap disminuye. (18). La timpanometría suele ser normal, con una curva tipo A de Jerger. El reflejo estapedial suele estar presente y resulta de utilidad para el diagnóstico diferencial con la otosclerosis, aunque no es una prueba patognomónica. Por tanto, es importante una correcta valoración audiométrica, ya que puede cumplir criterios de DCSS con presencia de hipoacusia de transmisión y ausencia de síntomas vestibulares. (19)
- Potenciales vestibulares Miogénicos Evocados (VEMPS):
La sensibilidad y especificidad de los cVEMPS para la DCSS es >80%.(20) En cuanto a los oVEMPS han demostrado ser más sensibles y específicos que los cVEMPS en 500Hz,asi como una mejor tolerancia y más rápidos de realizar.(21)
- Electrococleografía:
Los pacientes con DCSS presentan una elevación de la relación del potencial de sumación (SP) con respecto al potencial de acción (AP). Esta alteración de la relación SP/AP se corrige tras la reparación quirúrgica del canal afectado (22). Esta prueba, comúnmente utilizada para el diagnóstico de Enfermedad de Ménière, podría ser considerada como una prueba de criterio diagnóstico en un futuro.
- Tomografía Computarizada:
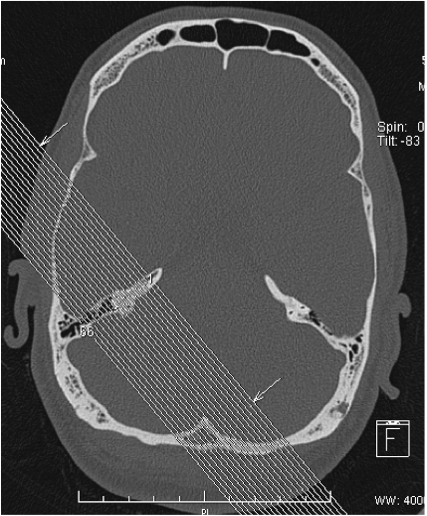
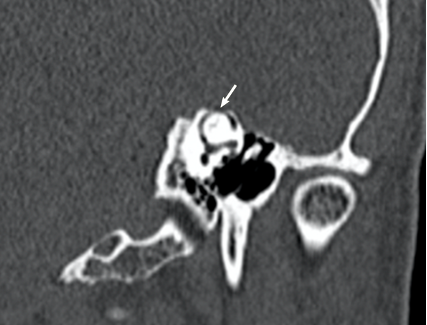
El TC debe realizarse con cortes de 0,5mm y una reconstrucción en el plano del canal semicircular superior (plano de Pöschl), con una sensibilidad de 97,6% y una especificidad del 100%. (23). (Imagen 1). La localización más común de la dehiscencia es el ápex (42,9%) (Imagen 2), brazo anterior (35,7%) y brazo posterior (10,7%), aunque debemos descartar dehiscencias del canal posterior y del lateral. (24). Se determinaron radiológicamente cuatro grados de severidad de la DCSS en función del grosor del hueso entre el CSS y la fosa craneal media.
- o Grado 1: > 2.5 mm;
- o Grado 2: < 2.5 mm
- o Grado 3: CSS en contacto con la fosa craneal media.
- o Grado 4: CSS abierto a la fosa craneal media.
Los grados 1 y 2 fueron considerados normales, el grado 3 como una predehiscencia y el grado 4 como una dehiscencia verdadera.
Se ha demostrado una relación directa significativa entre la edad y el grado de la DCSS, lo que respaldaría la hipótesis de la DCSS como una patología adquirida en lugar de congénita. (7)
- Resonancia Magnética
La Resonancia Magnética (RM) tiene mayor sensibilidad, especificidad y un mayor valor predictivo negativo que la TC.
Las mejores secuencias para la valoración de la DCSS mediante Resonancia Magnética son las potenciadas en T2, mostrándose una señal hiperintensa cuando el canal está lleno de perilinfa y una señal hipointensa cuando el laberinto está bloqueado. Por ello, es de gran utilidad para la valoración del resultado quirúrgico mediante plugging. (25)
Lo más importante de cara al tratamiento de la DCSS es definir bien los candidatos.
Los criterios diagnósticos consensuados de la Sociedad Bárány (12) son importantes para garantizar que los pacientes no reciban una cirugía innecesaria o, por el contrario, que a los pacientes que cumplan con los criterios diagnósticos se les ofrezca el asesoramiento adecuado sobre las diferentes opciones terapéuticas.
No se conocen tratamientos médicos efectivos para la DCSS. Mientras algunos pacientes con DCSS se contentan con tener una explicación para sus síntomas, algunos (alrededor del 50%), demandan una posible cirugía (2).
El tratamiento quirúrgico de la DCSS parece ser eficaz en la reducción de los síntomas. Mejora la calidad de vida y normaliza las pruebas diagnósticas, pero no todos los pacientes son subsidiarios del mismo (12).
La actitud inicial frente a una DCSS debe ser conservadora. Se debe recomendar al paciente evitar la exposición a posibles desencadenantes: maniobras de Valsalva, ruidos intensos o la práctica de buceo, entre otras. Las audioprótesis podrían estar indicadas según el nivel de pérdida auditiva. El seguimiento en consulta de Otoneurología ha de ser periódico, ofreciendo al paciente una posible rehabilitación vestibular. (26).
Ofrecemos cirugía a los pacientes en los casos en los que podemos relacionar sus síntomas a una DCSS y cuando éstos son incapacitantes. El objetivo de la cirugía es la eliminación de la fisiopatología de la tercera ventana móvil (2), excepto para pacientes que presentan síntomas inducidos por presión a los que se les puede ofrecer la colocación de un drenaje transtimpánico como paso previo a estas cirugías (26).
En la serie original de Minor et al, los pacientes se sometieron a cirugía de recubrimiento ± taponamiento del CSS por abordaje de fosa craneal media. Se observó que algunos de los pacientes originales que se sometieron a recubrimiento sin taponamiento experimentaron recurrencia de los síntomas después de la cirugía (27). Por este motivo, hoy en día se realiza de forma rutinaria taponamiento del CSS con diferentes materiales como fascia muscular, polvo o astillas de hueso, pegamento de fibrina o cemento de hidroxiapatita (2).
En la actualidad, las dos alternativas quirúrgicas que se pueden plantear son la reparación del defecto óseo o el refuerzo de la ventana redonda (2). Sin embargo, antes de someterse a una cirugía, el control de la migraña es fundamental para evitar la exacerbación de la misma después de la intervención y para distinguir síntomas tratables que es poco probable que se alivien con la reparación de la dehiscencia. Jung et al. mostraron que pacientes con migraña tienen mayor discapacidad por mareos que aquellos sin migraña, incluso después de la cirugía (28).
La selección del abordaje quirúrgico para reparar el canal dehiscente debe basarse en la anatomía del paciente y en la experiencia del cirujano (2). El abordaje por fosa craneal media (FCM) permite visualizar directamente el CSS dehiscente, asegurando que el canal esté adecuadamente taponado a ambos lados de la dehiscencia. En algunos casos en los que la dehiscencia se localiza adyacente al seno petroso superior o la cara más posterior del canal (cerca de la crus comunis), se prefiere el abordaje transmastoideo (TM) (2,14). Alternativamente, un endoscopio angulado puede extender la visualización para poder realizar el taponamiento a través del abordaje de la fosa craneal media. Es más, en algunos casos el abordaje transmastoideo no es factible debido a una mastoides contraída con un tegmen bajo (2). Una desventaja significativa del abordaje TM es la falta de visualización directa de la dehiscencia, lo que corre el riesgo de un tapón inadecuado a ambos lados de la dehiscencia. Algunos autores han sugerido que este problema puede eludirse elevando la duramadre sobre la dehiscencia a través de la mastoides y usando un espejo para asegurar que el canal esté adecuadamente taponado (2,14).
Alternativamente a los abordajes clásicos, se ha propuesto recientemente el refuerzo de la ventana redonda (RVR) como una alternativa mínimamente invasiva que tiene como objetivo el alivio de la sintomatología sin necesidad de cerrar el defecto del CSS. Se realiza un abordaje endoaural, con elevación del colgajo tímpano-meatal y cierre parcial de la ventana redonda con cartílago o fascia, utilizando la dehiscencia como segunda ventana del oído interno (29,30).
Generalmente, la evolución de los pacientes intervenidos es favorable, aunque la tasa de éxito y resolución de los síntomas de forma total o parcial varía según las series consultadas. En líneas generales, disminuyen los vértigos inducidos por presión o por sonido, la sensación de autofonía, el acúfeno y mejora la calidad de vida (2). Esto es debido a la eliminación de la tercera ventana móvil, que puede constatarse de manera objetiva mediante la normalización de los umbrales en los cVEMP, las amplitudes de los oVEMP (2,31) y en el cierre del GAP transmisivo en graves de la audiometría tonal liminar (2, 32).
Es esperable tras la cirugía una disminución en la función del CSS (2) que se produce aproximadamente en un tercio de los pacientes y suele tener un curso temporal. En aquellos casos en los que se realiza el sellado cerca de la crus comunis (15%), el material de taponamiento también puede afectar a la función del canal semicircular posterior. Se ha reportado la aparición de vértigo posicional paroxístico benigno (VPPB) en hasta el 25% de los pacientes (2).
Sorprendentemente, a pesar de exponer y manipular el laberinto membranoso en la cirugía, rara vez se produce una pérdida significativa de la audición, incluso en pacientes sometidos a cirugía de revisión. Se estima que aproximadamente el 25% de los pacientes desarrollan una hipoacusia neurosensorial de alta frecuencia. (2,32).
El taponamiento y las técnicas de cobertura se asocian con tasas de éxito más altas que las de repavimentación, sin aumentar el riesgo de pérdida auditiva. Cuando solo se realiza la repavimentación, no se garantiza un sellado completo del defecto, y esta área puede permanecer sensible a cambios de presión (14).
En casos de cirugía de revisión, las tasas de éxito son más bajas que en cirugía primaria (2).
Cada uno de los abordajes quirúrgicos tiene ventajas y desventajas. La FM ofrece mejor visión de la dehiscencia, que puede resultar beneficioso en el momento de la reparación, pero tiene mayor morbilidad que el abordaje TM.
En un estudio retrospectivo multicéntrico de 2019 (33), Schwartz et al. compararon los abordajes de FM y TM. Las dos cohortes tenían resultados audiométricos similares y una mejora similar en la autofonía, tinnitus pulsátil y vértigo-mareos inducidos por sonido. Igualmente, las tasas de complicaciones fueron similares. Sin embargo, hubo una tasa de revisión del 33,3% para el abordaje por fosa media en comparación con el 3,8% en el transmastoideo por motivos que no supieron esclarecer. Los pacientes con abordaje FM requirieron una estancia hospitalaria significativamente mayor que los tratados mediante abordaje TM.
Si bien ninguna técnica ha sido significativamente superior, ambas han demostrado ser efectivas en manos experimentadas.
El refuerzo de la ventana redonda presenta menor tiempo quirúrgico, morbilidad y estancia hospitalaria que las técnicas clásicas. Sin embargo, los resultados no tan buenos en comparación con las otras técnicas. En diferentes artículos se describe una mejoría total o parcial del mareo inducido por presión o sonido, autofonía y acúfenos, pero en la mayoría de los casos no se produce una mejoría de la audición e incluso se ha descrito un empeoramiento de 10 dB o más en el GAP transmisivo, lo que ha conducido a diferentes autores a abandonar el RVR como un tratamiento de primera línea (34).
En la siguiente tabla se detallan a modo de resumen las principales indicaciones, ventajas, desventajas y resultados de cada una de las técnicas mencionadas:

En definitiva, el manejo del Síndrome de la Dehiscencia del Canal Semicircular Superior continúa evolucionando. La estrategia de tratamiento ideal es específica para cada paciente y no existe ningún enfoque quirúrgico generalizado. Cada vez se identifican mejor los pacientes subsidiarios de cirugía y ciertas comorbilidades como la migraña que hacen que el éxito de la intervención sea menor. Las técnicas transmastoideas y el taponamiento del CSS de forma sistematizada han aumentado en popularidad y el papel del refuerzo de la ventana redonda aún se está definiendo.
El tratamiento quirúrgico de la DCSS ha ido en aumento en los últimos años. Este incremento ha permitido arrojar los primeros estudios con una cohorte de pacientes suficiente para establecer algunas de las complicaciones derivadas más frecuentes. Esto ha favorecido al cirujano a la hora de ajustar las expectativas al paciente en cuanto a hallazgos quirúrgicos o comorbilidades asociadas. Se estima una frecuencia general de 11,2% de complicaciones en el tratamiento quirúrgico, la mayoría de un nivel I en la escala complicaciones quirúrgicas de Clavien-Dindo que son aquellas que no necesitan tratamiento farmacológico, quirúrgico, endoscópico o de radiología intervencionista, incluyendo también las dehiscencias por infección de herida. Las complicaciones más frecuentes son el vértigo posicional paroxístico benigno (4,5%) (35,37), siendo el canal posterior el más afectado, hipoacusia neurosensorial profunda (2,5%) (35,37), parálisis facial transitoria (0,8%) o hematoma epidural (1,2%), sin encontrar diferencias entre el abordaje de fosa craneal media (FCM) o abordaje transmastoideo (TM), exceptuando la trombosis venosa profunda (18,1%) que ha mostrado ser más frecuente en el abordaje transmastoideo. (36)
Por otro lado, los pacientes intervenidos con escaso éxito quirúrgico en cuanto a la resolución de síntomas, la cirugía de revisión estaría indicada. En estos casos, la presencia de fístula de líquido cefalorraquídeo es una complicación presente hasta en un 67% de casos intervenidos mediante FMC. (38)
A su vez, se ha demostrado que algunas comorbilidades, como coagulopatías, predisponen al desarrollo de complicaciones postoperatorias. Los pacientes fumadores, hipertensos o inmunodeprimidos predisponen al desarrollo de infección postoperatoria. Por otra parte, hallazgos intraoperatorios como la exposición del ganglio geniculado pueden favorecer el desarrollo de parálisis facial transitoria. (36)
1. Minor LB, Solomon D, Zinreich JS, Zee DS. Sound- and/or pressure-induced vertigo due to bone dehiscence of the superior semicircular canal. Arch Otolaryngol Head Neck Surg. 1998 Mar;124(3):249-58.
2. Ward BK, Carey JP, Minor LB. Superior canal dehiscence syndrome: Lessons from the first 20 years. Front Neurol;8:1-10.
3. Sugihara EM, Babu SC, Kitsko DJ, Haupoert MS, Thottam PJ. Incidence of pediatric superior semicircular canal dehiscence and inner ear anomalies. Otol Neurotol. 2016 Oct; 37 (9): 1370-5.
4. Bom Braga GP, Noble JH, Gebrim EMMS, Labadie RF, Bento RF. The influence of the subarcuate artery in the superior semicircular canal dehiscence and its frequency on stillbirths: illustrative cases and systematic review. Acta Otolaryngol. 2018 May;138(5):437-442.
5. Noonan KY, Russo J, Shen J, Rehm H, Halbach S, Hopp E et al. CDH23 Related hearing loss. Otol Neurotol. 2016 Dec; 37:1583-8.
6. Niesten MEF, Lookabaugh S, Curtin H, Merchant SN, McKenna MJ, Grolman W et al. Familial Superior Canal Dehiscence Syndrome. JAMA Otolaryngol Neck Surg. 2014 Apr 1;140(4):363.
7. Klopp-Dutote N, Kolski C, Biet A, Strunski V, Page C. A radiologic and anatomic study of the superior semicircular canal. Eur Ann Otorhinolaryngol Head Neck Dis. 2016 Apr;133(2):91-4.
8. Sood D, Rana L, Chauhan R, Shukla R, Nandolia K. Superior semicircular canal dehiscence: A new perspective. Eur J Radiol Open. 2017 Nov 14;4:144-146.
9. Davey S, Kelly-Morland C, Phillips JS, Nunney I, Pawaroo D. Assessment of superior semicircular canal thickness with advancing age. Laryngoscope. 2015 Aug;125(8):1940-5
10. Watters KF, Rosowski JJ, Sauter T, Lee DJ. Superior semicircular canal dehiscence presenting as postpartum vertigo. Otol Neurotol. 2006 Sep;27(6):756-68.
11. Baloh RW. Superior semicircular canal dehiscence syndrome: Leaks and squeaks can make you dizzy. Neurology. 2004 Mar 9;62(5):684-5.
12. Ward BK, van de Berg R, van Rompaey V, Bisdorff A, Hullar TE, Welgampola MS, Carey JP. Superior semicircular canal dehiscence syndrome: Diagnostic criteria consensus document of the committee for the classification of vestibular disorders of the Bárány Society. J Vestib Res. 2021;31(3):131-141.
13. Lempert T, von Brevern M. Episodic vertigo. Curr Opin Neurol. 2005 Feb;18(1):5-9.
14. Palma Diaz M, Cisneros Lesser JC, Vega Alarcón A. Superior Semicircular Canal Dehiscence Syndrome - Diagnosis and Surgical Management. Int Arch Otorhinolaryngol. 2017 Apr;21(2):195-198.
15. Aladham Y, Ahmed O, Hassan SAS, Francis-Khoury E. Traumatic superior semicircular canal dehiscence syndrome: case report and literature review. J Surg Case Rep. 2021 Jan 25;2021(1):rjaa592.
16. Wackym PA, Balaban CD, Zhang P, Siker DA, Hundal JS. Third Window Syndrome: Surgical Management of Cochlea-Facial Nerve Dehiscence. Front Neurol. 2019 Dec 13;10:1281.
17. Naert L, Ocak I, Griet M, Van de Berg R, Stultiens JJA, Van de Heyning P, Bisdorff A, Sharon JD, Ward BK, Van Rompaey V. Prospective Analysis of an Evidence-Based Symptom Set in Superior Canal Dehiscence Syndrome. Otol Neurotol. 2021 Feb 1;42(2):e186-e192.
18. Chi F-L, Ren D-D, Dai C-F. Variety of Auiologic manifestations in patients with superior semicircular canal dehiscence. Otol Neurotol 2010; 31 (1): 2-10.
19. H.A. Arts, M.E. Adams, S.A. Telian, H. El-Kashlan and P.R. Kileny, Reversible electrocochleographic abnormalities in superior canal dehiscence, Otology & Neurotology 30(1) (2009), 79–86.
20. Zhou, D. Poe and Q. Gopen, Clinical use of vestibular evoked myogenic potentials in the evaluation of patients with air-bone gaps, Otology & Neurotology 33(8) (2012), 1368–1374.
21. K.L. Janky, K.D. Nguyen, M. Welgampola, M.G. Zuniga and J.P. Carey, Air-conducted oVEMPs provide the best separation between intact and superior canal dehiscent labyrinths, Otology & Neurotology 34(1) (2013), 127–134.
22. Sone M, Yoshida T, Morimoto K, Teranishi M, Nakashima T, Naganawa S. Endolynphatic hydrops in superior canal dehiscence and large vestibular aqueduct syndromes. Laryngoscope 2016;126(6): 1446-50.
23. Sparacia G, Iaia A. Diagnostic performance of reformatted isotropic thin-section helical CT images in the detection of superior semicircular canal dehiscence. Neuroradiol J. 2017;30(3):216-21.
24. Gartrell BC, Gentry LR, Kennedy TA, Gubbels SP. Radiographic features of superior semicircular canal dehiscence in the setting of chronic ear disease. Otol Neurotol 2014;35(1):91-6.
25. Browaeys P, Larson TL, Wong ML, Patel U. Can MRI replace CT in evaluating semicircular canal dehiscence? AJNR Am J Neuroradiol 2013; 34(7):1421-7.
26. Almela LT, Guillamon D, Martin Oviedo, C. Vértigo postraumático. Síndrome de la tercera ventana y fístula perilinfántica. Actualización en Otorrinolaringología y Cirugía de Cabeza y cuello. 2021 Nov.
27. Minor LB. Clinical manifestations of superior semicircular canal dehiscence. Laryngoscope. 2005 Oct;115(10):1717-27.
28. Jung DH, Lookabaugh SA, Owoc MS, McKenna MJ, Lee DJ. Dizziness is more prevalent than autophony among patients who have undergone repair of superior canal dehiscence. Otol Neurotol. 2015 Jan;36(1):126-32.
29. Nikkar-Esfahani A, Whelan D, Banerjee A. Occlusion of the round window: a novel way to treat hyperacusis symptoms in superior semicircular canal dehiscence syndrome. J Laryngol Otol. 2013 Jul;127(7):705-7.
30. Silverstein H, Kartush JM, Parnes LS, Poe DS, Babu SC, Levenson MJ, Wazen J, Ridley RW. Round window reinforcement for superior semicircular canal dehiscence: a retrospective multi-center case series. Am J Otolaryngol. 2014 May-Jun;35(3):286-93.
31. Welgampola MS, Myrie OA, Minor LB, Carey JP. Vestibular-evoked myogenic potential thresholds normalize on plugging superior canal dehiscence. Neurology. 2008 Feb 5;70(6):464-72.
32. Ward BK, Agrawal Y, Nguyen E, Della Santina CC, Limb CJ, Francis HW, Minor LB, Carey JP. Hearing outcomes after surgical plugging of the superior semicircular canal by a middle cranial fossa approach. Otol Neurotol. 2012 Oct;33(8):1386-91.
33. Schwartz SR, Almosnino G, Noonan KY, Banakis Hartl RM, Zeitler DM, Saunders JE, Cass SP. Comparison of Transmastoid and Middle Fossa Approaches for Superior Canal Dehiscence Repair: A Multi-institutional Study. Otolaryngol Head Neck Surg. 2019 Jul;161(1):130-136.
34. Walsh EM. Current management of superior semicircular canal dehiscence syndrome. Curr Opin Otolaryngol Head Neck Surg. 2020 Oct;28(5):340-345.
35. Vlastarakos PV, Proikas K, Tavoulari E, Kikidis D, Maragoudakis P, Nikolopoulos TP. Efficacy assessment and complications of surgical management for superior semicircular canal dehiscence: a meta-analysis of published interventional studies. Eur Arch Otorhinolaryngol. 2009;266:177-186.
36. Xie Y, Sharon JD, Pross SE, Abt NB, Varma S, Della Santina CC, Minor LB, Carey JP. Surgical Complications from Superior Canal Dehiscence Syndrome Repair: Two Decades of Experience. Otolaryngol Head Neck Surg. 2017 Aug;157(2):273-280.
37. Kirtane MV, Sharma A, Satwalekar D. Transmastoid repair of superior semicircular canal dehiscence. J Laryngol Otol. 2009 Mar;123(3):356-8.
38. Mozaffari K, Ghodrati F, Pradhan A, Ng E, Ding K, Rana S, Duong C, Anderson RN, Enomoto A, Sheppard JP, Sun MZ, Phillips HW, Yang I, Gopen Q. Superior Semicircular Canal Dehiscence Revision Surgery Outcomes: A Single Institution's Experience. World Neurosurg. 2021 Dec;156:e408-e414.
 Pasar al contenido principal
Pasar al contenido principal