Los paragangliomas (PGLs) son tumores benignos, altamente vascularizados, derivados del tejido cromafín y originados en el sistema paraganglionar tanto adrenal como extraadrenal, el cual se distribuye difusamente en relación con estructuras vasculares, ganglios, nervios craneales y ramas nerviosas del sistema nervioso autónomo. En cabeza y cuello suelen derivar del sistema paraganglionar extraadrenal parasimpático (SNP) siendo raramente productores de catecolaminas.
Se han denominado de muchas formas (glomus, quemodectomas, etc), pero hoy en día, según la OMS, el término adecuado para referirse a ellos es el de paraganglioma.
Los paragangliomas carotídeos son los más frecuentes en el área de cabeza y cuello. Aún así, son tumores raros con una incidencia estimada en los Países Bajos de 0.06 por 100.000 habitantes/año (1).
La mayoría de los PGLs carotídeos son esporádicos, pero aproximadamente el 10-50% son hereditarios (2-4). Las mutaciones germinales de los genes que codifican subunidades de la succinato-deshidrogenasa (SDH) son responsables del 80-90% de los casos familiares, pero alrededor de un tercio de los PGLs de cabeza y cuello aparentemente esporádicos también tienen alterados estos genes (5-7).
El complejo SDH (relacionado con el ciclo de Krebs) está compuesto por 4 subunidades; SDHA, SDHB, SDHC, SDHD. Existe una quinta denominada SDHAF2 que flavina a SDHA.
Estas actúan oxidando la succinato a fumarasa como parte de la cadena de transporte de electrones en la membrana interna de las mitocondrias. Su mutación causa la desestabilización del complejo SDH favoreciendo la estabilización del factor inducido por hipoxia y permitiendo la formación del tumor. Este complejo enzimático se relaciona con la aparición de tumores a través de varios mecanismos implicados en la proliferación celular, la apoptosis y la alteración de la función sensora del oxígeno, de los cuales ninguno ha podido atribuirse todavía con certeza como causa primigenia del desarrollo tumoral.
Las mutaciones en los genes SDHD y SDHB son las principales causantes de la aparición de PGLs en cabeza y cuello. Así, las mutaciones en SDHD explican el 94-96% de los PGLs familiares y el 34-36% de los casos esporádicos (5) y las mutaciones SDHB representan el 10-20% de los PGLs familiares y el 3-9% de los casos esporádicos (5,7). No obstante, esto varia en las diferentes series, teniendo en la nuestra una representación similar. Las mutaciones en SDHA, SDHC o SDHAF2 son infrecuentes.
En general, la transmisión es autosómica dominante, pero con penetrancia incompleta o expresión fenotípica variable. Sin embargo, las mutaciones germinales en los genes SDHD, SDHAF2 y MAX solamente desarrollan fenotipo tumoral cuando el alelo se hereda por vía paterna (imprinting). Además, la mutación en el gen SDHD se relaciona más frecuentemente con tumores multicéntricos (70% SDHD frente al 30% SDHB) mientras que la mutación en SDHB se asocia con PGLs más agresivos o malignos.
Estos no son los únicos genes relacionados con los PGLs. Hasta la fecha, se han identificado más de 20 genes (8) tanto en línea germinal (heredada) como somática (del tumor no heredada) con algún papel en su desarrollo (9). Estos genes se han clasificado teniendo en cuenta las diferentes vías de actuación, que se pueden resumir: a través del ciclo de Krebs, de la vía hipóxica y de la vía de las quinasas (10).
También se conocen los genes causantes de la mayoría de los síndromes asociados a PGLs, tales como la neoplasia endocrina múltiple tipo 1 y 2 (MEN1 y MEN2), la enfermedad de Von Hippel Lindau (VHL), la neurofibromatosis tipo 1 (NF1) y el síndrome de Carney-Stratakis (11,12).
Los PGLs carotídeos son los más frecuentes en el área de cabeza y cuello suponiendo el 60-70% de los mismos. Son seguidos por los yugulares y/o timpánicos (30-40%) y vagales (2-5%) (3,4).
La mayoría de los PGLs de cabeza y cuello son unifocales, pero se observa multifocalidad en el 10-20% de los casos esporádicos y en el 40-80% en las formas familiares, principalmente en los PGLs carotídeos (3,6,13,14).
El riesgo de malignidad es bajo en general, definido como la presencia de metástasis en tejido no neuroendocrino. En los PGLs carotídeos se sitúa entorno a un 3.8-6%, superior a la descrita en PGLs yugulotimpánicos (2-4%) e inferior a la descrita en PGLs vagales (16-19%) (3,4,6,15). Las metástasis son más frecuentes en las formas esporádicas que en las familiares y ocurren de forma más frecuente a nivel regional (ganglios linfáticos en el 25-70%) (6,14) que a distancia (pulmón, hígado o piel) (6).
Los PGLs carotídeos clásicamente se presentan como masas cervicales asintomáticas de lento crecimiento y, por lo tanto, habitualmente de larga evolución. La localización característica es la parte superior del cuello, donde se presentan en forma de masa externa (Figura 1.).

Figura 1. Paciente con paraganglioma carotídeo derecho.
El examen clínico demuestra la presencia de una masa móvil en sentido horizontal, pero fija en el plano vertical (lo que se conoce como signo positivo de Fontaine), y ocasionalmente con pulsaciones palpables o un soplo carotídeo. En etapas posteriores, la compresión de los nervios craneales (sobre todo X y XII, pero también VII, IX y XI) puede provocar disfagia, disfonía, hipomovilidad lingual (Figura 2.), disgeusia, dolor auricular, etc., pudiendo aparecer también accidentes cerebrovasculares transitorios o síncopes recurrentes. La afectación de la cadena simpática generará un síndrome de Horner.
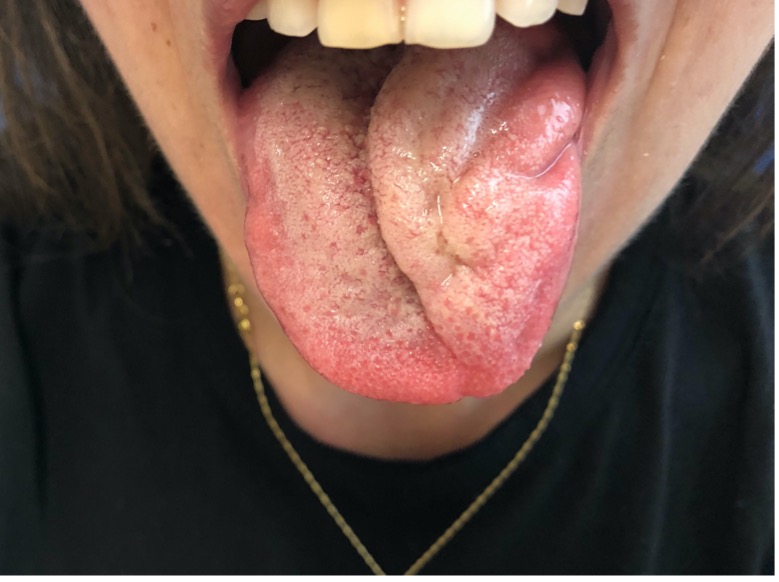
Figura 2. Paciente con parálisis del XII par izquierdo provocada por un gran paraganglioma carotídeo.
En una revisión de una serie multicéntrica de 95 pacientes con PGL carotídeo, el 67% inicialmente presentó solo una masa cervical, el 20% tenía una masa en el cuello con afectación de los pares craneales y el 11% presentó una masa en el cuello y algias cervicales (16). En las series españolas de González-Orus RJ y cols. (17) y Sevilla García MA y cols. (18) el 75-84% de los casos fueron diagnosticados por una masa cervical, siendo el resto un diagnóstico casual o como cribado familiar y presentando únicamente afectación de los pares craneales al diagnóstico en un 2.3%.
La presentación clínica de los PGLs carotídeos también va a depender de su capacidad para secretar catecolaminas y, aunque muy raramente, de su vinculación con síndromes hereditarios (como las manchas de café con leche o neurofibromas periféricos en la NF1 o el carcinoma medular de tiroides y/o hiperparatiroidismo en los síndromes MEN2, por poner algunos ejemplos).
Dado que la mayoría de los PGLs carotídeos y en general de cabeza y cuello, derivan del SNP solo un 3-5% son hiperfuncionantes. Por ello, en los PGLs carotídeos es poco probable encontrar clínica secretora (hipertensión arterial, cefalea, sudoración y taquicardia/palpitaciones), y si existe debe sospecharse un PGL a otro nivel.
A causa del riesgo de sangrado, no está indicada la realización de biopsias en estos tumores. Tampoco se aconseja la punción aspirativa con aguja fina (PAAF), aunque tiene menor riesgo hemorrágico que la biopsia, porque debido a su componente vascular suele tener falsos negativos.
Ante la sospecha clínica de un PGL carotídeo, y en general de cualquier PGL de cabeza y cuello, debemos realizar en todos los casos: 1) estudio genético, 2) determinación de metanefrinas y 3) pruebas de imagen. Con esto, podremos realizar el diagnóstico de PGLs familiares, de su funcionalidad, extensión, multicentricidad y malignidad para así plantear el mejor tratamiento.
Estudio genético
Es probable que entre el 30 % y el 50 % de los PGL sean causados por una mutación de la línea germinal, aunque hasta un 10 % de estos no serán identificados por las técnicas actuales de pruebas genéticas, porque algunos pacientes tienen mutaciones más raras no probadas o aún no identificadas.
El estudio genético es importante por la relación de algunas mutaciones con ciertos aspectos clínicos como la multicentricidad (SDHD), la malignidad (SDHB) o el desarrollo de otras enfermedades. Además, su estudio deriva en un consejo genético fundamental para estos pacientes y sus familiares, por ejemplo; las mutaciones en SDHB pueden estar asociadas al carcinoma de células renales, a tumores papilares tiroideos, neuroblastomas y tumores del estroma gastrointestinal. Otro ejemplo sería que la transmisión materna de los genes SDHD, SDHAF2 y MAX no da lugar al desarrollo tumoral por lo que la madre y sus descendientes no precisan seguimiento.
Hasta no hace mucho se habían identificado patrones de riesgo basados en edad y criterios clínicos para realizar las pruebas genéticas (15,19) pero con estos ejemplos y la prevalencia previamente mentada de algunas de estas mutaciones, entendemos que actualmente se recomiende realizar test genéticos basados en NGS (Next Generation Sequencing) a todos los pacientes con PGLs, independientemente de la edad o historia familiar previa (20,21).
En un consenso de 2017 (22) se ha recomendado testar al menos 10-15 genes de los más frecuentemente encontrados (ELGN1, EPAS1, FH, KIF1B, MAX, MDH2,NF1, RET, SDHA, SDHAF2, SDHB, SDHC, SDHD, TMEM127 y VHL) para detectar mutaciones, deleciones exónicas o duplicaciones. En caso de tratamiento quirúrgico en el que se puede obtener una muestra del tumor también es interesante hacer un estudio somático.
No obstante, debemos saber que los pacientes tienen un mayor riesgo de enfermedad familiar, incluso en ausencia de una mutación identificada, si; es menor de 30 años, tiene varios tumores o tiene antecedentes de PGLs familiares. Estos pacientes podrían benedificarse de la secuenciación del genoma completo.
Determinación de metanefrinas
Aunque los PGLs carotídeos funcionantes suponen menos de un 5%, se debe realizar la determinación de catecolaminas al diagnóstico, con más razón aún si se sospecha multicentricidad. Los PGLs de cabeza y cuello productores generalmente liberan noradrenalina.
El despistaje de “secretor” actualmente se realiza con la determinación de los niveles de metanefrinas en plasma: adrenalina, normetadrenalina y 3-metoxitiramina. También puede realizarse en orina de 24 horas pero, es menos sensible, menos específico y logísticamente más difícil (23).
Con una sola determinación de metanefrinas en plasma o en orina se excluye con bastante fiabilidad la presencia de un tumor productor de catecolaminas, excepto en los casos excepcionales de tumores exclusivamente productores de dopamina (24,25).
Pruebas de imagen
Existen dos pruebas de imagen; las anatómicas, cuyo objetivo principal es delimitar el tumor, y las funcionales, cuyo objetivo principal es detectar multicentricidad y metástasis.
Recientemente ha sido publicado un documento consenso de la Sociedad Británica de Base del Cráneo (23) sobre el manejo de los PGLs de cabeza y cuello. En él recomiendan realizar tomografía computarizada (TC) de base de cráneo y resonancia magnética (RM) de cabeza y cuello al diagnóstico y rastreo corporal con RM de cuerpo entero o con 68Ga-DOTATATE PET-TC. Sin embargo, numerosas publicaciones han demostrado la superioridad de determinadas pruebas funcionales con respecto a la RM, por lo que también serán discutidas a continuación.
Pruebas de imagen anatómicas
El ultrasonido se utiliza típicamente al inicio del diagnóstico para la evaluación inicial de una masa palpable en el cuello, por ser un examen simple y no invasivo, con sensibilidad y especificidad relativamente alta en la detección de PGLs carotídeos (26). Sin embargo, no siempre es necesario. La ecografía muestra una masa bien definida, heterogéneamente hipoecoica y centrada en la bifurcación carotídea (27,28). El estudio Doppler muestra la marcada vascularización con un flujo arterial de alta velocidad y baja resistencia, la relación y el grado de infiltración arterial y la posible presencia de complicaciones, como la trombosis de la vena yugular (5,6).
Las técnicas de imagen como la TC y la RM son imprescindibles en el estudio prequirúrgico ya que aportan datos sobre la naturaleza hipervascular tumoral, los márgenes lesionales, la infiltración de estructuras adyacentes y, si se hacen de cuerpo entero, permiten detectar la multifocalidad y la presencia de metástasis. También son indispensables para la valoración secuencial volumétrica en los casos no quirúrgicos, los controles postquirúrgicos y el cribado de las formas familiares. Generalmente se usan de forma combinada al diagnóstico para el estudio de PGLs múltiples pero, para el estudio concreto de los PGLs carotídeos la RM es considerada de elección pues nos permite valorar con mayor sensibilidad ciertos aspectos que pueden predecir morbilidad (29). Por ejemplo, si parece existir una afectación mural de la arteria carótida interna (ACI) que aumente el riesgo de lesión o sacrificio de la misma deberemos plantearnos algunas pruebas prequirúrgicas como el test de oclusión carotídeo.
La TC cervical y craneal multiplanar y de alta resolución (TCAR; < 1 mm) con administración de contraste intravenoso, en fase arterial, nos permite realizar el diagnóstico diferencial con otras lesiones no hipervasculares (principalmente las de estirpe neural) (30). Las reconstrucciones multiplanares y vasculares mediante proyecciones de máxima intensidad (MIP) o de volumen optimizan la localización tumoral y muestran con mayor nitidez la relación con las estructuras vasculares (2).
La apariencia típica de un PGL del cuerpo carotídeo mediante TC es la de una lesión de densidad de partes blandas, en el espacio carotídeo infrahioideo, con notable realce de la densidad, generalmente homogéneo tras la administración de contraste, y que produce una apertura del ángulo de bifurcación carotídeo entre la arteria carótida externa (ACE) y la ACI (signo de la lira) (Figura 3.).
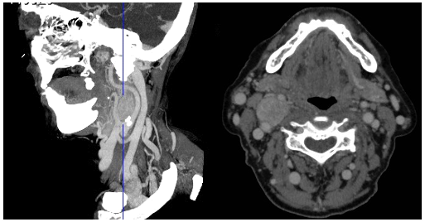
Figura 3. TC con contraste (corte sagital y coronal) que muestra un paraganglioma carotídeo derecho: signo de la lira.
Otras manifestaciones menos frecuentes en las lesiones voluminosas incluyen la heterogeneidad densitométrica, debida a fenómenos trombóticos o hemorrágicos, y su extensión al espacio suprahioideo (en un 8% de los casos) (31).
La RM craneal y cervical multiplanar con imágenes ponderadas en T1 y T2, junto con imágenes mejoradas con gadolinio, es la modalidad más sensible en la detección de PGLs, permitiendo diferenciarlos fácilmente de otras neoplasias de cabeza y cuello (3,32,33).
Las secuencias con supresión grasa potenciadas en T2 y con contraste en T1 permiten una correcta diferenciación de los límites tumorales. Los PGLs muestran una típica señal hipointensa en secuencias ponderadas en T1 e iso-hiperintensidad en T2. Asimismo, se pueden objetivar múltiples áreas serpiginosas o moteadas, con ausencia de señal en todas las secuencias, por la presencia de vacíos de flujo sanguíneo, combinadas con focos hiperintensos por presencia de flujo lento o de hemorragia en el interior de la lesión (34). Es el clásico signo en “sal y pimienta”, que suele visualizarse en el interior de lesiones mayores de 2 cm de diámetro (Figura 4.).
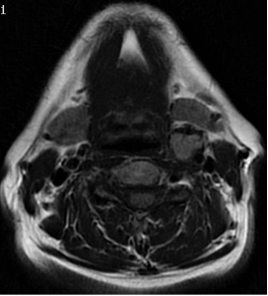
Figura 4. RMN en T1 (corte axial) que muestra un paraganglioma carotídeo izquierdo: signo en “sal y pimienta”.
Este signo no es patognomónico, ya que ha sido descrito en otras lesiones hipervasculares como las metástasis de carcinoma tiroideo y de células renales. Sin embargo, permite diferenciarlo de otros tumores como schwannomas y neurofibromas, que son menos vasculares y generalmente no tienen vacíos de flujo. Los PGLs muestran con mayor frecuencia una mejora ávida y homogénea después de la administración de gadolinio intravenoso.
La angiografía, ya sea con angio-TC, angio-RM o la angiografía por sustracción digital, se realiza como un complemento a la TC y RM, así como en el entorno preoperatorio. Su tasa de complicaciones (aproximadamente el 0,5-1%) resulta demasiado elevada para una aproximación exclusivamente diagnóstica (36). Sin embargo, estas modalidades permiten realizar el test de oclusión carotídeo y evaluar la perfusión tumoral identificando los vasos que nutren el tumor para guiar su embolización y el abordaje quirúrgico (36).
La arteria faríngea ascendente es el principal aporte vascular. De todos estos, parece que los estudios mediante RM de angiografía dinámica con contraste por vía intravenosa aportan una caracterización más eficaz. Estudios comparativos de diferentes secuencias angiográficas mediante RM concluyen que las incidencias coronales y secuencias axiales en 3D TOF (time of flight), sin y tras la administración de contraste por vía intravenosa, identifican mejor las arterias aferentes. En segundo lugar, con esta secuencia se obtiene mayor resolución espacial (cortes de 1-1,5 mm de grosor), que mejora la detección de tumores de pequeño tamaño, particularidad muy útil en los estudios de cribado familiares. Por otra parte, permite la realización de reconstrucciones multiplanares, de volumen y MIP, que optimizan las relaciones anatómicas tumorales (37).
Pruebas de imagen funcionales
Una vez caracterizado cualquier PGL, debe descartarse enfermedad multicéntrica y metastásica. Aunque la RM de cuerpo entero es útil y recomendada para esto (23), las técnicas de imagen funcionales con isótopos han demostrado mayor sensibilidad y especificidad (38,39). Además, al ser técnicas que no detectan tejido cicatricial o de relleno, son capaces de identificar, con alta precisión, recidiva o tumor residual tras la cirugía, de ahí su importancia también en el seguimiento de estos pacientes.
En cuanto a las pruebas funcionales se han empleado muchas: la gammagrafía con distintos radioisótopos como 123I-metayodobencilguanidina (MIBG), 131I-MIBG, 111-In octreótida (OctreoScan®) y la tomografía por emisión de positrones-TC (PET-TC) con 18F-3,4-dihidroxifenilalanina (18F-FDOPA), 18F-dopamina (18F-FDA), la 18F-fluorodesoxiglucosa (18F-FDG) y 68Ga combinado con análogos de la somatoestatina.
Actualmente, se ha demostrado que el 18F-FDOPA PET-TAC (38,39) es un excelente examen de primera línea para la detección de formas multifocales en el contexto de PGLs de cabeza y cuello dada la disponibilidad y la superior sensibilidad (cercana al 100%) frente a otras pruebas anatómicas o funcionales. Por ejemplo, en la Figura 6. se muestra como 18F-DOPA PET es capaz de detectar pequeñas lesiones timpanoyugulares que no son visibles en las imágenes morfológicas.
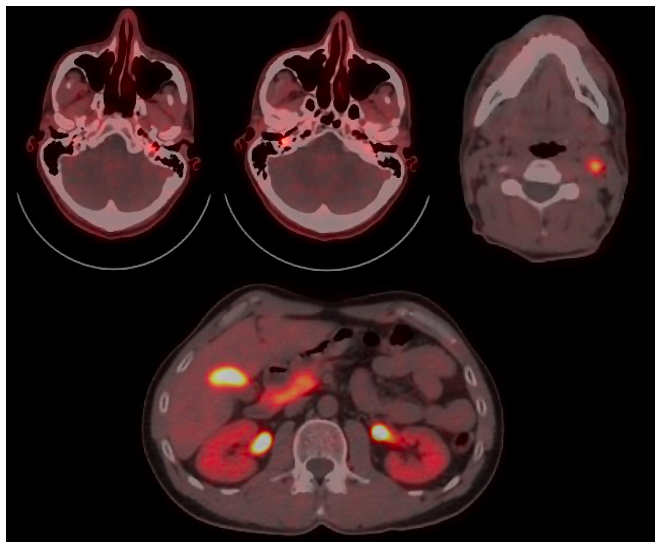
Figura 6. PET-TAC con 18F-DOPA (corte axial). Se muestran paragangliomas múltiples (yugulotimpánico bilateral, carotídeo izquierdo y suprarrenal bilateral) con una metástasis hepática. El paraganglioma yugulotimpánico izquierdo no era identificable en la TC de base de cráneo por su pequeña dimensión.
No obstante, la sensibilidad del PET-TC con 68Ga combinado con análogos de la somatoestatina (DOTATOC [Tyr3-octreótido], DOTATATE [Tyr3-octreotato], DOTANOC [Nal3-octreótido]) es aún superior (100%) al 18F-FDOPA PET-TAC con una baja tasa de falsos positivos (38-40). Sin embargo su utilización clínica aún no está generalizada en los centros españoles.
Si solo consideráramos las formas metastásicas en contexto de mutación SDHB y los feocromocitomas, el PET-TC con 18F-FDG podría proporcionar información adicional por lo que se ha sugerido que la estadificación tumoral puede mejorarse combinando 18F-FDOPA y 18F-FDG PET-TC (38,41), aunque su uso exclusivo es menos específico en PGLs de cabeza y cuello.
Dado que se tratan de tumores benignos con un potencial de complicaciones amplio, su tratamiento y manejo es siempre individualizado. Para ello debemos tener en cuenta: 1)el tamaño del tumor, 2)la tasa de crecimiento, 3)el estudio de la mutación y su penetrancia, 4)la presencia de malignidad definida por enfermedad metastásica, 5)el estado secretorio, 6)la existencia de tumores sincrónicos, 7)los síntomas asociados y 8)las comorbilidades del paciente.
La toma de decisiones compartida entre el equipo y el paciente es fundamental, teniendo en cuenta que los pacientes tendrán sus propias preferencias en cuanto al tratamiento y que la gestión puede variar entre los centros debido a las diferencias en la experiencia y las instalaciones. No obstante, se debe optar por el tratamiento que previsiblemente aporte el mejor resultado con la menor morbilidad posible.
En los PGLs de cabeza y cuello, en general, existen 3 pilares fundamentales de tratamiento; la cirugía, la radioterapia (RT) y la vigilancia activa.
En los PGLs carotídeos se debe considerar inicialmente un tratamiento conservador y discutir el tratamiento activo (radioterapia o cirugía) si el tumor muestra crecimiento. Sin embargo, el manejo conservador no está libre de riesgos, ya que existe un riesgo significativo de complicaciones (parálisis del nervio craneal) a lo largo de la vida debido al manejo conservador, y la cirugía generalmente, aporta un riesgo aceptable y baja tasa de secuelas previsibles en tumores pequeños.
Una entidad especial aún más conservadora en su manejo, son los PGLs carotídeos bilaterales (Figura 7.). Con el fin de evitar la insuficiencia barorrefleja (42), la estrategia más aceptada es mantener los tumores bajo observación o tratar uno (el de mayor tamaño) o ambos con radioterapia si están en crecimiento.
Figura 7. TC con contraste (corte axial) que muestra paragangliomas carotídeos bilaterales.
Cirugía
A pesar de su ubicación en una zona anatómicamente favorable en comparación con el paraganglioma yugular o vagal, la extirpación total de estas lesiones puede estar acompañada de una morbilidad significativa.
En 1970, Shamblin (43), propuso una clasificación para evaluar la extensión de los PGLs carotídeos. Esta clasificación contiene dos componentes básicos que son, si existe o no afectación circunferencial del tumor en relación con los vasos carotídeos y si existe infiltración de las paredes vasculares por el tumor. El tipo 1 denota tumores bien localizados, no adheridos a los vasos y fácilmente resecables; en el tipo 2 el tumor se adhiere y rodea parcialmente los vasos, y en el tipo 3 el tumor tiene una relación íntima y adherente con toda la circunferencia de la bifurcación y ambas carótidas.
Una limitación de esta clasificación es que no define si la afectación de la arteria por el tumor es lo suficientemente profunda como para hacer imposible la disección sin sacrificio vascular. Por ello, Luna-Ortiz y cols. (44), apoyados en el trabajo previo de Davidge-Pitts y Pantonowitz (45), propusieron una modificación de la clasificación de Shamblin para establecer de forma más objetiva su correlación con la morbilidad (Figura. 8). En ella, además de incluir la invasión de la pared vascular y la afectación de la circunferencia vascular, introdujeron el tamaño tumoral >4 cm como un predictor de la dificultad quirúrgica. Así, el mayor tiempo quirúrgico y el mayor riesgo de sangrado se observa en tumores IIIa y el mayor riesgo de sacrificio vascular se observa en tumores con afectación estrecha vascular (Shamblin IIIb). La morbilidad neurológica no está relacionada con estas clasificaciones y solo refleja la experiencia del cirujano en la disección de estos tumores (44).

Figura 8. Modificación de la clasificación de Shamblin propuesta por Luna-Ortiz y cols (44).
Se han hecho intentos para clasificar las PGLs antes de la operación. Arya y cols. (29) describieron una clasificación que se define antes de la operación en RM y que es usada también con este fin. Sin embargo, la infiltración del tumor de la pared carotídea solo puede percibirse durante la cirugía.
Por lo tanto, la cirugía suele considerarse de elección en los siguientes casos de PGLs carotídeos en crecimiento: pacientes jóvenes (<50 años), baja morbilidad esperable (Shamblin I y II), tumores secretores, comportamiento tumoral maligno o déficits de pares craneales.
En este último caso, se debe tener cuidado, ya que a menudo se produce un mayor déficit después de la extirpación del tumor.
La técnica quirúrgica más recomendada es la resección craneocaudal subadventicial, a través del espacio avascular entre los vasos del sistema carotídeo y el tumor. Sin embargo, algunos autores prefieren la disección adventicial. En tumores grandes, el mejor plano de disección se puede encontrar en la cara dorsolateral de la arteria carótida interna o en la cara ventrolateral de la carótida externa. Finalmente, se continúa la disección hacia la bifurcación carotídea. La cara posterior de la bifurcación es un punto crucial, zona donde se producen la mayoría de las lesiones vasculares. La otra zona problemática en la disección es el polo superior del tumor ya que suelen crecer longitudinalmente y pueden alcanzar la base del cráneo. En estos casos, el control de la ACI puede ser muy difícil. Durante esta disección pueden aparecer episodios de bradicardia e hipotensión debido a la estimulación de los barorreceptores, pudiéndose infiltrar con lidocaína al 1% el plano subadventicial del bulbo carotídeo.
El sangrado excesivo puede hacer complicada la resección quirúrgica, sin embargo, la embolización preoperatoria dentro de las 48h antes de la cirugía, aunque supone una reducción del tiempo quirúrgico y del volumen de pérdida de sangre intraoperatoria, no ha demostrado una reducción de la tasa de complicaciones y aún está cuestionada por muchos autores (46).
En cuanto a cuestiones preanestésicas, los PGLs carotídeos ya hemos visto que son raramente productores, pero sí pueden desarrollarse conjuntamente con otros PGLs más frecuentemente funcionantes, como los abdominales. Por este motivo, si existiera una hipersecreción de catecolaminas, con el fin de controlar la tensión, se debe realizar una preparación farmacológica con alfa-bloqueantes (de elección Fenoxibenzamina [23]) al menos 3-4 días antes. Rara vez se requiere bloqueo beta, ya que los PGLs carotídeos secretores producen norepinefrina y no epinefrina. Si el paciente presenta taquicardia persistente o trastornos del ritmo cardíaco, por el propio tumor o tras el inicio del alfa-bloqueo, habría que añadirlo, pero nunca antes de que el alfa-bloqueo esté establecido.
En los casos en los que se sospeche una afectación vascular amplia se debe realizar una prueba de oclusión carotídea por la eventualidad de que haya que sacrificar la carótida por infiltración masiva o por rotura en las maniobras de despegamiento. No obstante, esta situación no es un hecho frecuente, y en la mayoría de los PGLs carotídeos, se puede preservar la carótida interna (47). Estos casos complejos a menudo requieren una combinación de varias modalidades de tratamiento para obtener los mejores resultados posibles de control local con la menor morbilidad. La necesidad o no de un tratamiento quirúrgico radical lo condicionarán factores como la edad y el estado de salud del paciente, así como la penetrancia de las mutaciones causantes de la formación de los PGLs o el comportamiento biológico del tumor. Si hubiera que sacrificar dicha arteria, se puede realizar la resección subtotal (seguida o no de radioterapia) o realizar la reconstrucción de la arteria con un injerto de vena safena o una prótesis. Sin embargo, el accidente cerebrovascular (ACV) permanente y la hemorragia ocurren más frecuentemente en casos de reparación vascular (44).
Esta circunstancia llevó a introducir técnicas endovasculares en el manejo de la ACI, especialmente en PGLs yugulotimpánicos complejos (48), pero también en los PGLs carotídeos (49). Las técnicas en PGL carotídeos incluyen la oclusión preoperatoria de la ACI con balón permanente (PBO, por sus siglas en inglés) y el refuerzo con stents. Hoy en día rara vez empleamos PBO como resultado de la introducción del refuerzo con stents.
Estas técnicas pretenden ayudar al cirujano a retirar el tumor completamente con mínima morbilidad y mortalidad. Principalmente se indican si (49):
- Existe invasión de la pared arterial mostrada en la angiografía con estenosis o irregularidades de la luz arterial de la ACI.
- Mala compensación del flujo sanguíneo cerebral contralateral a través del polígono de Willis.
- Cirugía previa con manipulación de la ACI o RT previa.
- ACI ipsilateral única.
No obstante, la indicación debe ser valorada cuidadosamente teniendo en cuenta la edad y el estado general del paciente.
La inserción del stent refuerza la arteria y permite establecer un plano de clivaje en la superficie externa del stent para poder realizar una disección carotídea más agresiva reduciendo la posibilidad de lesión vascular (48,50). Se recomienda un intervalo de al menos 4 a 6 semanas entre la colocación del stent y la cirugía, para permitir la formación de un revestimiento neointimal que estabilice la superficie luminal del stent (49). Para reducir la posibilidad de lesionar la ACI en la interfaz stent-tumor, se recomienda reforzar con el stent al menos 10 mm de la pared del vaso libre de tumor, tanto proximal como distalmente. En ocasiones, para conseguirlo es necesario colocar 2 o incluso 3 stents (49,50).
El principal inconveniente asociado con el refuerzo arterial con stents es la necesidad de terapia antiplaquetaria de por vida. Para prevenir la trombosis inducida por el stent, se debe instaurar doble terapia antiplaquetaria (Ticoplidina 250 mg c/12 h o Clopidogrel 75mg día + Adiro 100mg día) 5-7 días antes de la inserción del stent (48,50). Esta combinación se mantiene durante al menos 1 mes después del procedimiento, para continuar seguidamente con Adiro de forma indefinida (48,50). Cinco días antes de la cirugía, se suspenden los antiagregantes plaquetarios y se inicia el tratamiento con heparina de bajo peso molecular. Los antiagregantes plaquetarios se reanudan 2 días después de la cirugía y la heparina de bajo peso molecular se suspende 3 días después (50).
Los stents desnudos no disminuyen el sumistro vascular al tumor. Sin embargo, los stents recubiertos tienen varias desventajas teóricas, como el aumento de la trombogenicidad, rigidez y mayor dificultad en el posicionamiento en ángulos arteriales, en comparación con los stents desnudos. En la actualidad, se considera que los stents desnudos Xpert (Abbott Vascular, Irlanda) y Astron (Biotronik SE, Berlín, Alemania) son los más adecuados para reforzar tanto la porción cervical como la petrosa de la ACI debido a su diámetro (4 o 5 mm), longitud (20, 30 o 40 mm), flexibilidad (durante el despliegue endovascular) y resiliencia durante la disección quirúrgica (49,50).
La evaluación a largo plazo de la permeabilidad del la ACI, la disección o la trombosis con el stent se realiza por ultrasonido y se necesitan estudios a más largo plazo. Sin embargo, la experiencia actual sugiere que el procedimiento está prácticamente libre de riesgos a corto y largo plazo (49,50).
Existen casos en los que el despliegue del stent puede verse obstaculizado (49,50):
- Estenosis luminal severa.
- Infiltración parietal masiva.
- Debilidad de la pared del vaso debido a un tratamiento previo (cirugía o radioterapia).
- Un curso tortuoso de la ACI en la base del cráneo.
En estos casos la PBO representa la alternativa endovascular preferida. La selección cuidadosa es vital porque no todos los pacientes pueden tolerar el procedimiento. Existen varias pruebas para la preparación de la PBO pero ninguna es infalible. Se considera que la PBO se puede realizar si el paciente ha tolerado la prueba de oclusión carotídea con balón y los datos angiográficos demuestran un buen llenado cruzado de al menos 1 de los 2 sistemas comunicantes (49).
La PBO también facilita la extirpación tumoral radical, permite la movilización segura del PGL sin riesgo de hemorragia incontrolable por rotura carotídea y permite desvascularizar el tumor.
Hay algunas preocupaciones sobre el uso de la PBO, especialmente en pacientes jóvenes, debido al aumento del riesgo de aneurismas intracraneales posteriores. Por este motivo se recomienda el control de la presión intracraneal a los 5 y 10 años (49).
Se recomienda un intervalo de 3 a 4 semanas antes de la cirugía porque la anestesia general causa hipotensión con posterior insuficiencia hemodinámica. Este retraso permite la adaptación de la vasculatura intracraneal a la nueva hemodinámica y reduce la posibilidad de complicaciones (48,50).
Zane y cols. (51) publicaron la serie más grande de oclusión permanente de la ACI con balón en paragangliomas yugulotimpánicos. Trataron a 31 pacientes y tuvieron dos complicaciones neurológicas importantes: un accidente cerebrovascular con hemiplejía permanente tras la PBO y otro tras la cirugía que atribuyeron a su temprana realización. En un seguimiento de 10 años no observaron complicaciones tardías.
Radioterapia
Las nuevas formas de planificación y administración de la radioterapia (3D-CRT/RT con intensidad modulada) frente a la RT externa clásica (EBRT) y el desarrollo de la radiocirugía estereotáxica (SRS) (52) han disminuido significativamente los efectos secundarios de su aplicación (estenosis carotídea, ACV, etc) considerándose una opción segura en el tratamiento de los PGLs (53,54). La SRS se usa más frecuentemente en PGL yugulares o vagales (55).
La tasa de mortalidad y el control tumoral no varía significativamente entre la cirugía, la radioterapia y las diferentes modalidades de RT entre sí, pero la tasa de complicaciones mayores (neurológicas y vasculares) es mayor con cirugía (4,55,56).
Las principales desventajas son que el objetivo de la RT es la inhibición del crecimiento en lugar de la eliminación del tumor y que parece menos sensible en pacientes con PGLs secretores (57).
Un riesgo a tener siempre en cuenta de la RT es el riesgo cancerígeno, que es comparable en términos absolutos entre IMRT y radioterapia conformal tridimensional con un rango entre 1 y 1.6%, dependiendo de la ubicación del área irradiada (58).
Por este motivo, la radioterapia suele considerarse de elección en los siguientes casos de PGLs carotídeos en crecimiento: pacientes >65-75 años, alta morbilidad esperable (Shamblin III), tumores irresecables, residuales, bilaterales o riesgo de ello (SDHD).
Aunque no es del todo conocido, el mecanismo de acción de la radioterapia parece que se debe a la inducción de una endarteritis obliterativa con fibrosis del componente vascular del tumor, que actuaría evitando el crecimiento tumoral o incluso produciendo cierto grado de regresión (59,60).
La dosis necesaria de radioterapia, idealmente con radioterapia de intensidad modulada, para el control de los PGLs benignos es de 45-54 Gy en 25 fracciones de 1.8-2 Gy (5 semanas). La dosis de SRS se suele aplicar de 21-24 Gy en 3 fracciones o hipofraccionada con 25-30 Gy en 5 fracciones. En los PGLs malignos existe mucha menos experiencia con la RT, recomendándose dosis de hasta 70 Gy en dosis diarias de 2 Gy con cirugía del tumor primario.
Recientemente se están utilizando tratamientos con protonterapia con un excelente control local, reducción del volumen y mejoría clínica (62). Sin embargo, la disponibilidad de esta tecnología aún no está ampliamente generalizada.
Vigilancia activa
En ocasiones, el tratamiento puede ser más dañino que la enfermedad. Por este motivo, la vigilancia activa es la mejor opción en tumores que no muestran crecimiento. Se basa en ir controlando la evolución del tumor con pruebas de imagen periódicas y, en algunos casos, con metanefrinas en plasma.
La tasa de crecimiento de los PGLs carotídeos varía mucho según diferentes estudios (4,63,64) pero la mayor probabilidad de crecimiento está relacionada con una menor edad o un menor volumen tumoral (63). De hecho, ya se han propuesto modelos predictivos del crecimiento esperable de un PGL basándose en estos dos parámetros (63).
Así, en términos generales, se justifica especialmente una actitud conservadora en pacientes de edad avanzada, comorbilidad alta, riesgo de complicaciones quirúrgicas elevado o tumores multicéntricos.
Otros tratamientos
Los resultados de la quimioterapia clásica son modestos. El tratamiento más utilizado incluye la combinación de ciclofosfamida, vincristina y dacarbazina, con o sin adriamicina (CVD o CyVADIC), que puede ofrecer respuestas (con mejoría sintomática y hormonal) en torno al 50%, aunque de corta duración (con excepciones) y sin grandes beneficios en la supervivencia (65).
La actividad de otros agentes, como la gemcitabina, la combinación de adriamicina y estreptozocina o placlitaxel, se ha evaluado en pequeños estudios y debe confirmarse en ensayos más extensos.
Actualmente, la terapia con análogos de somatostatina marcados con un radionucléido adecuado se muestra como una alternativa relativamente eficaz en casos de PGLs malignos (2,3,23). Aunque existen varios (111octreótida ,131I-MIBG, 123I-MIBG, 90Y-DOTATATE, etc.), el más prometedor parece ser el 177Lu-DOTATATE (Lutathera®), recientemente aprobado en Estados Unidos para el tratamiento de tumores neuroendocrinos (2). Existen diversos trabajos que avalan su relativa eficacia, pero aún se investiga en el campo de una menor dosificación para prevenir efectos secundarios (crisis de catecolaminas) o bien su aplicación en estadios más precoces.
La temozolomida es una opción terapéutica adicional en PGL malignos y metastásicos (23).
Con otros tratamientos existen posibilidades (66), aunque ninguno se ha mostrado lo suficientemente eficaz, tales como los antiangiogénicos o los inhibidores de la tirosina cinasa (sunitinib, entre otros) (67).
A largo plazo, el control de los PGLs carotídeos es del 93,8 % de los que reciben tratamiento quirúrgico con resección total y del 94,5% de los que reciben radioterapia (4). Sin embargo, el riesgo de crecimiento si la resección es subtotal es significativo (23).
En cuanto a los PGLs no tratados, la mayoría tienen una evolución indolente, pero debemos saber que tienden a comportarse de forma más agresiva que los PGL yugulares (y menos que los vagales) (23). Las tasas de aumento de volumen tumoral significativo durante el seguimiento (considerándose un aumento del 20% del volumen tumoral) son variables en las series publicadas (64,68). En general, se estima que la tasa media de crecimiento de los PGLs carotídeos es de 1,6 mm/año (23). De cualquier modo, dado que existe una fuerte correlación entre el tamaño del tumor y el aumento de las complicaciones relacionadas con el tratamiento quirúrgico, prestar atención al crecimiento es crucial. Para ello, se realizará una RM de cabeza y cuello anualmente, pudiendo ampliar este intervalo si no se observa crecimiento tumoral (23). Durante el seguimiento, también hay que evaluar la aparición de nuevos tumores. Para ello está indicado el rastreo corporal con RM de tórax-abdomen-pelvis, 18F-FDOPA PET-TC o 68Ga-DOTATATE PET-TC. Además, será necesario realizar anualmente un estudio de metanefrinas en plasma en PGLs con estudio genético positivo, tumores secretores intervenidos y tumores multicéntricos. Esto se discutirá más detalladamente en el capítulo de la web de "protocolos de cribado y seguimiento de PGLs".
Lesiones Vasculares
Con la evolución de la planificación preoperatoria y la técnica quirúrgica, la necesidad de sacrificar la carótida y el riesgo de lesión es mínimo (4,55). El sacrificio de la vena yugular interna, la arteria carótida externa y la carótida interna se ha establecido en 6-11%, 13-33% y 2-11%, respectivamente (44). Por otro lado, la tasa de lesión vascular de la carótida interna con necesidad de reparación vascular varía del 13.3 al 54.2% en grandes series (69).
La necesidad de sacrificar la carótida depende del tamaño; es probable que los tumores Shamblin III requieran reconstrucción carotídea. En cuanto al riesgo de lesión intraoperatoria de la ACI, existe un alto riesgo si (49):
- El tumor reviste más del 180º de la circunferencia.
- Hay evidencia de estenosis o irregularidad de la pared vascular en pruebas de imagen.
- Han recibido tratamiento previo (radioterapia o cirugía) alrededor de la ACI.
Si se produce una rotura accidental de la carótida, se puede realizar la reconstrucción de la arteria con un injerto de vena safena o un parche de Goretex.
El accidente cerebrovascular (ACV) permanente y la hemorragia ocurren más frecuentemente en casos de reparación vascular. La tasa de incidencia del ACV después de la cirugía es del 2-3% (4,44).
Con la RT cervical, se ha descrito una tasa de ACV del 2,6% a largo plazo, sin embargo, parece más próxima al 0% en los estudios sobre PGLs (4). La estenosis carotídea asintomática mayor del 50% puede ocurrir hasta en el 30-40% de los radiados (70,71).
Insuficiencia barorrefleja
Después de la resección de tumores del cuerpo carotídeo bilateral, se pierde el reflejo barorreceptor y es inevitable la denervación bilateral del seno carotídeo, lo que resulta en hipertensión refractaria lábil postoperatoria, taquicardia, diaforesis y dolor de cabeza. El tratamiento de elección a largo plazo es la clonidina (42).
Lesión del nervio craneal
Las lesiones nerviosas ocurren con frecuencia por la propia afectación del tumor, y menos frecuentemente por lesiones no previstas durante la disección quirúrgica. La tasa de daño neurológico postquirúrgico permanente oscila entre el 7 y el 44 % (4,44,72). El riesgo quirúrgico de lesión nerviosa depende del tamaño tumoral (más frecuente en tumores mayores de 4 cm) y el crecimiento hacia la base de cráneo (44). Las lesiones más frecuentes son las del X y XII par craneal que pueden acarrear dificultades deglutorias en estos pacientes que deberán ser rehabilitadas.
Con la radioterapia, la lesión nerviosa resulta prácticamente nula (4) de hecho, la probabilidad de mejora en la función de los pares craneales es posible e inversamente proporcional a la duración de la neuropatía pudiendo ocurrir en el 39% de los casos (10% completa) (73).
BIBLIOGRAFÍA
- Plukker JT, Brongers EP, Vermey A, Krikke A, van den Dungen JJ. Outcome of surgical treatment for carotid body paraganglioma. Br J Surg. 2001; 88:1382-6.
- Lee JH, Barich F, Karnell LH, Robinson RA, Zhen WK, Gantz BJ, Hoffman HT; American College of Surgeons Commission on Cancer; American Cancer Society. National Cancer Data Base report on malignant paragangliomas of the head and neck. Cancer. 2002; 94(3):730-7.
- Pellitteri PK, Rinaldo A, Myssiorek D, Gary Jackson C, Bradley PJ, Devaney KO, Shaha AR, Netterville JL, Manni JJ, Ferlito A. Paragangliomas of the head and neck. Oral Oncol. 2004; 40(6):563-75.
- Suárez C, Rodrigo JP, Ferlito A, Cabanillas R, Shaha AR, Rinaldo A. Tumours of familial origin in the head and neck. Oral Oncol. 2006; 42(10):965-78.
- Badenhop RF, Jansen JC, Fagan PA, Lord RS, Wang ZG, Foster WJ, Schofield PR. The prevalence of SDHB, SDHC, and SDHD mutations in patients with head and neck paraganglioma and association of mutations with clinical features. J Med Genet. 2004; 41(7):e99.
- Oosterwijk JC, Jansen JC, van Schothorst EM, Oosterhof AW, Devilee P, Bakker E, Zoeteweij MW, van der Mey AG. First experiences with genetic counselling based on predictive DNA diagnosis in hereditary glomus tumours (paragangliomas). J Med Genet. 1996;33(5):379-83.
- Lefebvre M, Foulkes WD. Pheochromocytoma and paraganglioma syndromes: genetics and management update. Curr Oncol. 2014;21(1):e8-e17.
- Antonio K, Valdez MMN, Mercado-Asis L, Taïeb D, Pacak K. Pheochromocytoma/paraganglioma: recent updates in genetics, biochemistry, immunohistochemistry, metabolomics, imaging and therapeutic options. Gland Surg. 2020;9(1):105-23.
- Patel D, Phay JE, Yen TWF, Dickson PV, Wang TS, Garcia R, Yang AD, Kim LT, Solórzano CC. Update on Pheochromocytoma and Paraganglioma from the SSO Endocrine and Head and Neck Disease Site Working Group, Part 2 of 2: Perioperative Management and Outcomes of Pheochromocytoma and Paraganglioma. Ann Surg Oncol. 2020 May;27(5):1338-47.
- Björklund P, Pacak K, Crona J. Precision medicine in pheochromocytoma and paraganglioma: current and future concepts. J Intern Med. 2016;280(6):559-73.
- Núñez Lozano M, González Sarmiento R. Bases genéticas y moleculares de los paragangliomas. Acta Otorrinolaringol Esp. 2009;60(Supl. 1):24-8.
- Guha A, Musil Z, Vicha A, Zelinka T, Pacak K, Astl J, Chovanec M. A systematic review on the genetic analysis of paragangliomas: primarily focused on head and neck paragangliomas. Neoplasma. 2019;66(5):671-80.
- Turchini J, Cheung VKY, Tischler AS, De Krijger RR, Gill AJ. Pathology and genetics of phaeochromocytoma and paraganglioma. Histopathology. 2018;72(1):97-105.
- Boedeker CC, Ridder GJ, Schipper J. Paragangliomas of the head and neck: diagnosis and treatment. Fam Cancer. 2005;4(1):55-9.
- Neumann HP, Erlic Z, Boedeker CC, Rybicki LA, Robledo M, Hermsen M, Schiavi F, Falcioni M, Kwok P, Bauters C, Lampe K, Fischer M, Edelman E, Benn DE, Robinson BG, Wiegand S, Rasp G, Stuck BA, Hoffmann MM, Sullivan M, Sevilla MA, Weiss MM, Peczkowska M, Kubaszek A, Pigny P, Ward RL, Learoyd D, Croxson M, Zabolotny D, Yaremchuk S, Draf W, Muresan M, Lorenz RR, Knipping S, Strohm M, Dyckhoff G, Matthias C, Reisch N, Preuss SF, Esser D, Walter MA, Kaftan H, Sto ver T, Fottner C, Gorgulla H, Malekpour M, Zarandy MM, Schipper J, Brase C, Glien A, Ku hnemund M, Koscielny S, Schwerdtfeger P, Va lima ki M, Szyfter W, Finckh U, Zerres K, Cascon A, Opocher G, Ridder GJ, Januszewicz A, Suarez C, Eng C. Clinical predictors for germ line mutations in head and neck paraganglioma patients: cost reduction strategy in genetic diagnostic process as fall-out. Cancer Res. 2009; 69:3650-6.
- Sajid MS, Hamilton G, Baker DM; Joint Vascular Research Group. A multicenter review of carotid body tumour management. Eur J Vasc Endovasc Surg. 2007;34(2):127-30.
- Feng N, Zhang WY, Wu XT. Clinicopathological analysis of paraganglioma with literature review. World J Gastroenterol. 2009;15(24):3003-8.
- Sevilla García MA, Llorente Pendás JL, Rodrigo Tapia JP, García Rostán G, Suárez Fente V, Coca Pelaz A, Suárez Nieto C. Head and neck paragangliomas: revision of 89 cases in 73 patients. Acta Otorrinolaringol Esp. 2007;58(3):94-100.
- Lenders JW, Duh QY, Eisenhofer G, Gimenez-Roqueplo AP, Grebe SK, Murad MH, Naruse M, Pacak K, Young WF Jr; Endocrine Society. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2014;99(6):1915-42.
- Hermsen MA, Sevilla MA, Llorente JL, Weiss MM, Grimbergen A, Allonca E, Garcia-Inclán C, Balbín M, Suárez C. Relevance of germline mutation screening in both familial and sporadic head and neck paraganglioma for early diagnosis and clinical management. Cell Oncol. 2010;32(4):275-83.
- Hampel H, Bennett RL, Buchanan A, Pearlman R, Wiesner GL; Guideline Development Group, American College of Medical Genetics and Genomics Professional Practice and Guidelines Committee and National Society of Genetic Counselors Practice Guidelines Committee. A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med. 2015;17(1):70-87.
- NGS in PPGL (NGSnPPGL) Study Group, Toledo RA, Burnichon N, Cascon A, Benn DE, Bayley JP, Welander J, Tops CM, Firth H, Dwight T, Ercolino T, Mannelli M, Opocher G, Clifton-Bligh R, Gimm O, Maher ER, Robledo M, Gimenez-Roqueplo AP, Dahia PL. Consensus Statement on next-generation-sequencing-based diagnostic testing of hereditary phaeochromocytomas and paragangliomas. Nat Rev Endocrinol. 2017;13(4):233-47.
- Lloyd S, Obholzer R, Tysome J; BSBS Consensus Group. British Skull Base Society Clinical Consensus Document on Management of Head and Neck Paragangliomas. Otolaryngol Head Neck Surg. 2020 Sep;163(3):400-409.
- van Berkel A, Lenders JW, Timmers HJ. Diagnosis of endocrine disease: Biochemical diagnosis of phaeochromocytoma and paraganglioma. Eur J Endocrinol. 2014;170(3):R109-19.
- Pacak K, Wimalawansa SJ. Pheochromocytoma and paraganglioma. Endocr Pract. 2015;21(4):406-12.
- Hoang VT, Trinh CT, Lai TAK, Doan DT, Tran TTT. Carotid body tumor: a case report and literature review. J Radiol Case Rep. 2019;13(8):19-30.
- Steinke W, Hennerici M, Aulich A. Doppler color flow imaging of carotid body tumors. Stroke.1989;20(11):1574-7.
- Thelen J, Bhatt AA. Multimodality imaging of paragangliomas of the head and neck. Insights Imaging. 2019;10(1):29.
- Arya S, Rao V, Juvekar S, Dcruz AK. Carotid body tumors: objective criteria to predict the Shamblin group on MR imaging. AJNR Am J Neuroradiol. 2008; 29:1349-54.
- Woolen S, Gemmete JJ. Paragangliomas of the Head and Neck. Neuroimaging Clin N Am. 2016;26(2):259-78.
- Som PM, Biller HF, Lawson W, Sacher M, Lanzieri CF. Parapharyngeal space masses: an updated protocol based upon 104 cases. Radiology. 1984;153(1):149-56.
- Petropoulos AE, Luetje CM, Camarata PJ, Whittaker CK, Lee G, Baysal BE. Genetic analysis in the diagnosis of familial paragangliomas. Laryngoscope. 2000;110(7):1225-9.
- Moore MG, Netterville JL, Mendenhall WM, Isaacson B, Nussenbaum B. Head and Neck Paragangliomas: An Update on Evaluation and Management. Otolaryngol Head Neck Surg. 2016;154(4):597-605.
- Vogl TJ, Juergens M, Balzer JO, Mack MG, Bergman C, Grevers G, Lissner J, Felix R. Glomus tumors of the skull base: combined use of MR angiography and spin-echo imaging. Radiology. 1994;192(1):103-10.
- Heiserman JE, Dean BL, Hodak JA, Flom RA, Bird CR, Drayer BP, Fram EK. Neurologic complications of cerebral angiography. AJNR Am J Neuroradiol. 1994;15(8):1401-7.
- Amin MF, El Ameen NF. Diagnostic efficiency of multidetector computed tomography versus magnetic resonance imaging in differentiation of head and neck paragangliomas from other mimicking vascular lesions: comparison with histopathologic examination. Eur Arch Otorhinolaryngol. 2013;270(3):1045-53.
- van den Berg R, Wasser MN, van Gils AP, van der Mey AG, Hermans J, van Buchem MA. Vascularization of head and neck paragangliomas: comparison of three MR angiographic techniques with digital subtraction angiography. AJNR Am J Neuroradiol. 2000;21(1):162-70.
- Guichard JP, Fakhry N, Franc J, Herman P, Righini CA, Taieb D. Morphological and functional imaging of neck paragangliomas. Eur Ann Otorhinolaryngol Head Neck Dis. 2017;134(4):243-8.
- Janssen I, Chen CC, Taieb D, Patronas NJ, Millo CM, Adams KT, Nambuba J, Herscovitch P, Sadowski SM, Fojo AT, Buchmann I, Kebebew E, Pacak K. 68Ga-DOTATATE PET/CT in the Localization of Head and Neck Paragangliomas Compared with Other Functional Imaging Modalities and CT/MRI. J Nucl Med. 2016;57(2):186-91.
- Kroiss A, Putzer D, Frech A, Decristoforo C, Uprimny C, Gasser RW, Shulkin BL, Url C, Widmann G, Prommegger R, Sprinzl GM, Fraedrich G, Virgolini IJ. A retrospective comparison between 68Ga-DOTA-TOC PET/CT and 18F-DOPA PET/CT in patients with extra-adrenal paraganglioma. Eur J Nucl Med Mol Imaging. 2013;40(12):1800-8.
- Taïeb D, Tessonnier L, Sebag F, Niccoli-Sire P, Morange I, Colavolpe C, De Micco C, Barlier A, Palazzo FF, Henry JF, Mundler O. The role of 18F-FDOPA and 18F-FDG-PET in the management of malignant and multifocal phaeochromocytomas. Clin Endocrinol (Oxf). 2008 ;69(4):580-6.
- Díaz-Molina JP, Sevila MA, Llorente-Pendás JL, Suárez-Nieto C. Fallo barorreceptor tras la resección bilateral de paragangliomas carotídeos. Acta OtorrinolaringolEsp. 2010;61(1):78–80.
- Shamblin WR, ReMine WH, Sheps SG, Harrison Jr EG. Carotid body tumor(chemodectoma). Clinicopathologic analysis of ninety cases. Am J Surg. 1971;122(6):732–9.
- Luna-Ortiz K, Rascon-Ortiz M, Villavicencio-Valencia V, Herrera-Gomez A.Does Shamblin’s classification predict postoperative morbidity in carotid bodytumors? A proposal to modify Shamblin’s classification. Eur Arch Otorhino-laryngol. 2006;263(2):171–5.
- Davidge-Pitts KJ, Pantanowitz D. Carotid body tumor. Surg Ann. 1984; 16:203–7.
- Texakalidis P, Charisis N, Giannopoulos S, Xenos D, Rangel-Castilla L, Tassiopoulos AK, Jabbour P, Grossberg JA, Machinis T. Role of Preoperative Embolization in Carotid Body Tumor Surgery: A Systematic Review and Meta-Analysis. World Neurosurg. 2019;129:503-13.
- Sevilla García MA, Llorente Pendás JL, Rodrigo Tapia JP, García Rostán G, Suárez Fente V, Coca Pelaz A, Suárez Nieto C. Paragangliomas de cabeza y cuello: revisión de 89 casos en 73 pacientes [Head and neck paragangliomas: evisión of 89 cases in 73 patients]. Acta Otorrinolaringol Esp. 2007;58(3):94-100.
- Sanna M, Piazza P, De Donato G, Menozzi R, Falcioni M. Combined endovascular-surgical management of the internal carotid artery in complex tympanojugular paragangliomas. Skull Base. 2009 Jan;19(1):26-42. Bacciu A, Prasad SC, Sist N, Rossi G, Piazza P, Sanna M. Management of the cervico-petrous internal carotid artery in class C tympanojugular paragangliomas. Head Neck. 2016;38(6):899-905.
- Piazza P, Di Lella F, Bacciu A, Di Trapani G, Ait Mimoune H, Sanna M. Preoperative protective stenting of the internal carotid artery in the management of complex head and neck paragangliomas: long-term results. Audiol Neurootol. 2013;18(6):345-52.
- Bacciu A, Prasad SC, Sist N, Rossi G, Piazza P, Sanna M. Management of the cervico-petrous internal carotid artery in class C tympanojugular paragangliomas. Head Neck. 2016;38(6):899-905.
- Zane RS, Aeschbacher P, Moll C, Fisch U. Carotid occlusion without reconstruction: a safe surgical option in selected patients. Am J Otol. 1995; 16:353–59.
- Hu K, Persky MS. Treatment of Head and Neck Paragangliomas. Cancer Control. 2016;23(3):228-41.
- Scott AS, Parr LA, Johnstone PA. Risk of cerebrovascular events after neck and supraclavicular radiotherapy: a systematic review. Radiother Oncol. 2009; 90:163–5.
- Haynes JC, Machtay M, Weber RS, Weinstein GS, Chalian AA, Rosenthal DI. Relative risk of stroke in head and neck carcinoma patients treated with external cervical irradiation. Laryngoscope. 2002; 112:1883-7.
- Suárez C, Rodrigo JP, Bödeker CC, Llorente JL, Silver CE, Jansen JC, Takes RP, Strojan P, Pellitteri PK, Rinaldo A, Mendenhall WM, Ferlito A. Jugular and vagal paragangliomas: Systematic study of management with surgery and radiotherapy. Head Neck. 2013;35(8):1195-204.
- Makeieff M, Raingeard I, Alric P, Bonafe A, Guerrier B, Marty-Ane Ch. Surgical management of carotid body tumors. Ann Surg Oncol. 2008;15(8):2180-6.
- Glasscock ME, Jackson CG. Glomus tumors: diagnosis and surgery. Rev Laryngol Otol Rhinol (Bord). 1979;100(1-2):131-6.
- Ruben JD, Davis S, Evans C, Jones P, Gagliardi F, Haynes M, Hunter A. The effect of intensity-modulated radiotherapy on radiation-induced second malignancies. Int J Radiat Oncol Biol Phys. 2008; 70:1530-6.
- Nieto Palacios A, Martínez Álvarez R, del Barco Morillo E. Otras alternativas terapéuticas: radioterapia y quimioterapia. Acta Otorrinolaringol Esp. 2009;60(Supl. 1):130-6.
- Varma A, Nathoo N, Neyman G, Suh JH, Ross J, Park J, Barnett GH. Gamma knife radiosurgery for glomus jugulare tumors: volumetric analysis in 17 patients. Neurosurgery. 2006;59(5):1030-6.
- Gilbo P, Tariq A, Morris CG, Mendenhall WM. External-beam radiation therapy for malignant paraganglioma of the head and neck. Am J Otolaryngol. 2015;36(5):692-6.
- Kang KH, Lebow ES, Niemierko A, Bussière MR, Dewyer NA, Daly J, McKenna MJ, Lee DJ, Loeffler JS, Busse PM, Shih HA. Proton therapy for head and neck paragangliomas: A single institutional experience. Head Neck. 2020;42(4):670-7.
- Heesterman BL, de Pont LMH, Verbist BM, van der Mey AGL, Corssmit EPM, Hes FJ, van Benthem PPG, Jansen JC. Age and Tumor Volume Predict Growth of Carotid and Vagal Body Paragangliomas. J Neurol Surg B Skull Base. 2017;78(6):497-505.
- Langerman A, Athavale SM, Rangarajan SV, Sinard RJ, Netterville JL. Natural history of cervical paragangliomas: outcomes of observation of 43 patients. Arch Otolaryngol Head Neck Surg. 2012;138(04):341-5.
- Zukauskaite R, Hjorthgau K, Poulsen PL, Baerentzen S, Ladekarl M. Malignant pheochromocytoma and paraganglioma: three cases illustrating the use of molecular targeted diagnostics and therapy and possible role of new drugs. Acta Oncol. 2011;50(8):1255-9.
- Toledo R, Jimenez C. Recent advances in the management of malignant pheochromocytoma and paraganglioma: focus on tyrosine kinase and hypoxia-inducible factor inhibitors. F1000Res. 2018;7:F1000 Faculty Rev-1148.
- Guo Z, Lloyd RV. Pheochromocytomas and Paragangliomas: An Update on Recent Molecular Genetic Advances and Criteria for Malignancy. Adv Anat Pathol. 2015;22(5):283-93.
- Jansen JC, van den Berg R, Kuiper A, van der Mey AG, Zwinderman AH, Cornelisse CJ. Estimation of growth rate in patients with head and neck paragangliomas influences the treatment proposal. Cancer. 2000;88(12):2811-6.
- Smith JJ, Passman MA, Dattilo JB, Guzman RJ, Naslund TC, Netterville JL: Carotid body tumor resection: does the need for vascular reconstruction worsen outcome? Ann Vasc Surg. 2006; 20: 435–439.
- Hill AB. Should patients be screened for asymptomatic carotid artery stenosis. Can J Surg. 1998;41:208-13.
- Brown PD, Foote RL, McLaughlin MP, Halyard MY, Ballman KV, Collie AC, et al. A historical prospective cohort study of carotid artery stenosis after radiotherapy for head and neck malignancies. Int J Radiat Oncol Biol Phys. 2005;63:1361-7.
- Lamblin E, Atallah I, Reyt E, Schmerber S, Magne JL, Righini CA. Neurovascular complications following carotid body paraganglioma resection. Eur Ann Otorhinolaryngol Head Neck Dis. 2016;133(5):319-24.
- Gottfried ON, Liu JK, Couldwell WT. Comparison of radiosurgery and conventional surgery for the treatment of glomus jugulare tumors. Neurosurg Focus. 2004;17(2):E4.
 Pasar al contenido principal
Pasar al contenido principal