Los paragangliomas (PGLs) de cabeza y cuello se manifiestan típicamente en gente joven, en torno a las 5 o 6ª década de la vida. Como sabemos, un posible manejo es la vigilancia activa. En estos casos, es importante valorar el crecimiento o el cambio de comportamiento tumoral ya que nos obligará a plantear un tratamiento activo. La literatura sugiere que la mitad de los PGLs de cabeza y cuello mostrarán crecimiento después del diagnóstico (1). Por otro lado, si se realiza tratamiento quirúrgico o radioterápico el seguimiento óptimo sigue siendo necesario pues persiste el riesgo de aparición de un nuevo PGL o de recurrencia a largo plazo. Por todo ello, es de especial importancia determinar cuándo, cómo y cada cuánto debemos realizar el seguimiento en estos pacientes.
El cribado de las formas familiares es también de gran importancia ya que al menos un 50% de los PGLs son de origen hereditario (2). Esto permitirá evaluar el riesgo de estos familiares de padecer un PGL u otra enfermedad y establecer un consejo genético basado en la probabilidad de transmitir esta condición a su descendencia.
La mayoría de las guías de práctica clínica, no han aclarado cómo realizar el seguimiento clínico de estos pacientes de forma óptima. Tampoco ha habido estudios aleatorizados que aborden el seguimiento óptimo, y muchas preguntas clínicamente relevantes aún no han sido respondidas: la duración adecuada del seguimiento sigue sin estar clara y no se han homogeneizado las pruebas de imagen que deben realizarse.
En Septiembre de 2020 la Sociedad Británica de Base de Cráneo (1) publicó un consenso para el manejo de todas las formas de PGLs de cabeza y cuello basándose en las guías de práctica clínica siguientes:
- ‘‘National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology: Neuroendocrine Tumours’’ (2016) (3).
- ‘‘Pheochromocytoma and Paraganglioma: An Endocrine Society Clinical Practice Guideline’’ (2014) (4).
- ‘‘The North American Neuroendocrine Society Consensus Guideline for the Diagnosis and Management of Neuroendocrine Tumors: Phaeochromocytoma, Paraganglioma and Medullary Thyroid Cancer’’ (2010) (5).
- ‘‘EANM 2012 Guidelines for Radionuclide Imaging of Phaeochromocytoma and Paraganglioma” (6).
- ‘‘European Society of Endocrinology Clinical Practice Guideline for Long-term Follow-up of Patients Operated on for Phaeochromocytoma or a Paraganglioma’’ (2016) (7).
En Enero de 2021 nuestro grupo publicó el esquema que desarrollamos en el Hospital Universitario Central de Asturias para el cribado y seguimiento de pacientes con PGLs el cual lleva poniéndose en práctica desde hace tres años (8).
Aún no se dispone de un algoritmo estratificado por el riesgo. Por este motivo, no podemos olvidar un enfoque individualizado que considere la preocupación por la enfermedad, la edad, el tamaño y la ubicación tumoral y el estudio genético del paciente para establecer aún mejor la frecuencia y la duración del seguimiento.
Evaluar el crecimiento tumoral durante el seguimiento no es fácil. La tasa media de crecimiento de los PGLs yugulotimpánicos es de 0,4 mm/año, y la de los tumores del cuerpo carotídeo y los PGLs vagales es de 1,6 mm/año (9). El error interobservador e intraobservador basado en mediciones lineales de resonancia magnética (RM) puede ser de hasta 2 mm. Por este motivo, puede ser difícil identificar estos pequeños cambios de un año a otro pero, el crecimiento puede identificarse fielmente después de períodos más prolongados de vigilancia y una vez que sea mayor de 2 mm (1).
Si los PGLs son tratados con resección quirúrgica total, el riesgo de nuevos eventos (recurrencia local, metástasis o nuevos tumores) no es despreciable, aproximadamente un 5 % cada 5 años de seguimiento, y persiste a largo plazo (7,10). Este riesgo es mayor en los PGLs de cabeza y cuello por el simple hecho de ser PGLs extraadrenales (7).
Si bien existen informes sobre el valor pronóstico de otras características clínicas, bioquímicas, genéticas, de imagen y patológicas, no existen índices pronósticos sólidos de recurrencia tumoral en pacientes con PGL que puedan usarse para guiar la práctica clínica (7). La única excepción es que la probabilidad de nuevos eventos parece ser mayor en pacientes con tumores hereditarios que también son más jóvenes, tienen tumores más grandes y con mayor frecuencia tienen tumores múltiples, que los pacientes con tumores esporádicos (10-15).
Existe una correlación genotipo-fenotipo que aumenta aún más la importancia de realizar un correcto cribado y seguimiento de estos pacientes. Es ampliamente conocido que la mutación más frecuente, la del gen SDHD, se relaciona con multicentricidad y que el mayor riesgo de malignidad y la menor supervivencia específica para enfermedad se relaciona con la mutación del gen SDHB. Gimenez-Togueplo AP y cols. (16) informaron una tasa de malignidad del 87 % (7 de 8) de los PGLs con mutación germinal SDHB en comparación con una tasa del 26 % (20 de 76) de los PGLs sin mutación SDHB. En un estudio más grande realizado por Neumann HP y cols. (17) la tasa de malignidad fue del 34,3 % (11 de 34) para los pacientes con mutación SDHB. Amar L y cols. informaron que la supervivencia a 5 años después del diagnóstico de metástasis fue del 36 % para aquellos con mutación SDHB en comparación con el 67 % para aquellos sin mutaciones SDHB. El riesgo de muerte fue 2,7 veces mayor según el análisis multivariante en pacientes con mutación SDHB (18).
Se recomienda el seguimiento clínico anual para evaluar una posible progresión clínica en relación con la afectación de nuevos pares craneales.
A fin de plantear modificar los periodos de seguimiento de una forma segura, la Sociedad Británica de Base de Cráneo (1) establece los siguientes predictores de crecimiento:
- Estudio genético positivo.
- Antecedentes familiares de PGLs.
- Edad al diagnóstico <30 años.
- Origen del tumor: el riesgo de malignidad es mayor en el PGL vagal> carotídeo> yugular o timpánico.
Por otro lado, cuando los tumores han permanecido estables durante varios años, puede aumentarse el intervalo de seguimiento.
Deben de realizarse las siguientes pruebas durante el diagnóstico y seguimiento de pacientes con PGL: estudio genético, determinación de metanefrinas y pruebas de imagen.
En la Figura 1. se muestra el protocolo de cribado y seguimiento del Hospital Universitario central de Asturias.
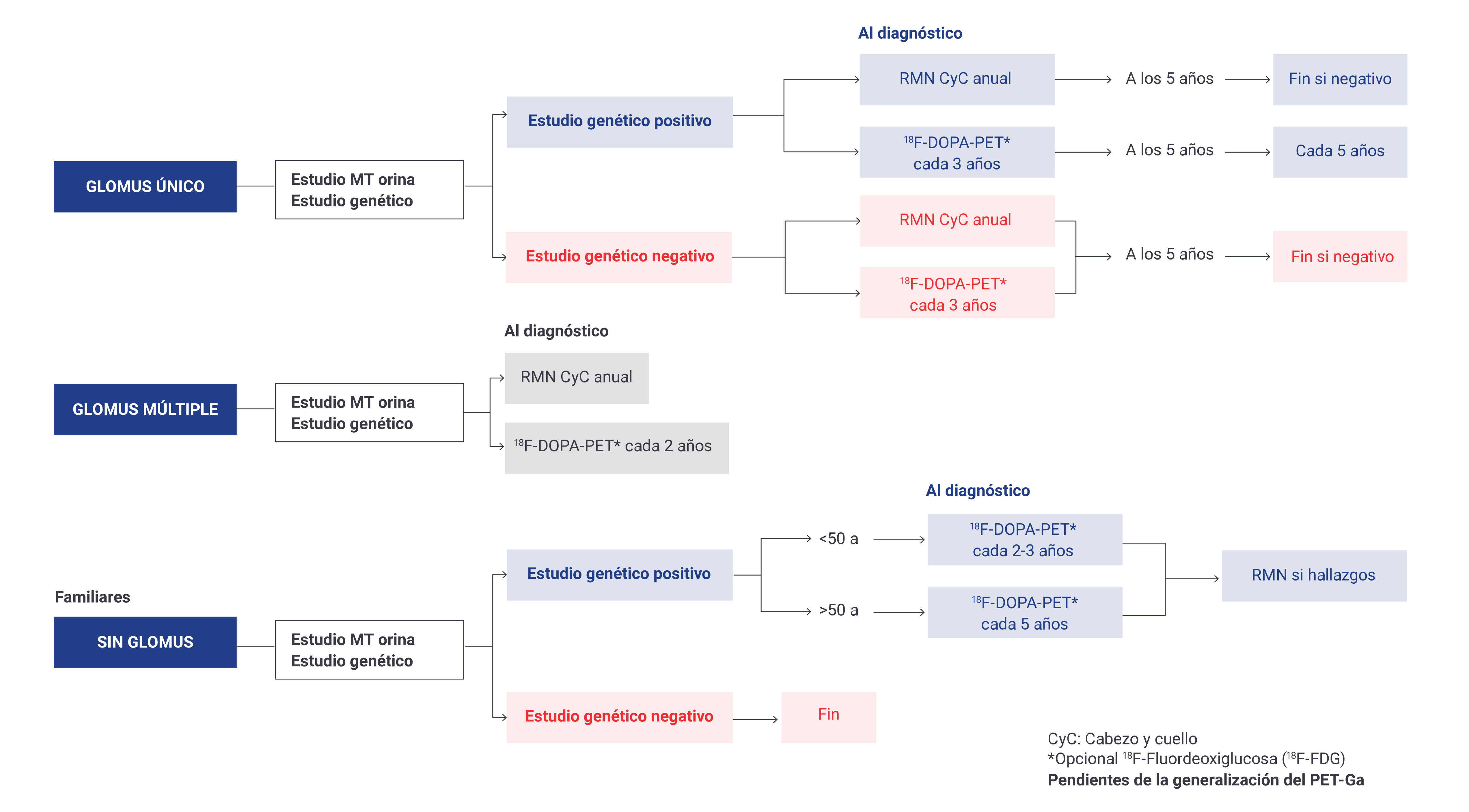
Figura 1. Protocolo de seguimiento de pacientes con paragangliomas de cabeza y cuello en el Hospital Universitario central de Asturias (8).
PRUEBAS AL DIAGNÓSTICO
1. ESTUDIO GENÉTICO
Es probable que entre el 30 % y el 50 % de los PGLs sean causados por una mutación de la línea germinal, aunque hasta el 10 % de estas mutaciones no se identificarán mediante las técnicas actuales de pruebas genéticas, porque algunos pacientes tienen mutaciones raras no probadas o una mutación aún no identificada (19).
El papel de las pruebas genéticas es estratificar el riesgo del comportamiento tumoral y desarrollo de futuros tumores. Por ejemplo, las mutaciones en SDHB aumentan el riesgo de un comportamiento maligno y están asociadas con el carcinoma de células renales, carcinoma papilar de tiroides, neuroblastomas y tumores del estroma gastrointestinal.
Un documento de consenso reciente hizo recomendaciones con respecto a qué genes deben incluirse en el panel genético (Next Generation Sequencing, NGS); ELGN1, EPAS1, FH, KIF1B, MAX, MDH2, NF1, RET, SDHA, SDHAF2, SDHB, SDHC, SDHD, TMEM127 y VHL (19).
No obstante, hay pacientes que tienen un mayor riesgo de enfermedad familiar, incluso en ausencia de una mutación identificada que podrían beneficiarse de la secuenciación del genoma/exoma completo. Son los siguientes:
- Edad < 30 años.
- Presencia de varios PGLs.
- Antecedentes familiares de PGLs.
Ha sido reconocido el valor del uso de un algoritmo de diagnóstico basado en características clínicas para establecer las prioridades de las pruebas genéticas (4). En nuestro centro, salvo que haya características sindrómicas, realizamos primeramente la determinación de los genes SDHD y SDHB y solo si son negativos realizamos el estudio del panel completo.
2. DETERMINACIÓN DE METANEFRINAS
Un 10% de los PGLs de cabeza y cuello producen hormonas, principalmente norepinefrina. A todos los pacientes se les deben medir los niveles de metanefrinas en plasma o en orina de 24 horas al diagnóstico: adrenalina, normetadrenalina y 3-metoxitiramina. Reconocemos que la determinación en orina de 24 horas, parece ser menos sensible y menos específica (1,4) pero sobre todo logísticamente más difícil.
Con solo una determinación puede excluirse o confirmarse que una lesión es secretora, excepto en los casos excepcionales (<5%) de tumores exclusivamente productores de dopamina.
3. PRUEBAS DE IMAGEN
Las imágenes morfológicas y funcionales son necesarias en todos los pacientes para confirmar el diagnóstico e identificar enfermedad multifocal.
Se recomienda realizar al diagnóstico:
1. RM de cabeza y cuello. La Sociedad Británica de Base de Cráneo recomienda realizar además TC de base de cráneo al diagnóstico a todos los pacientes con PGL (1). En nuestro caso, realizamos complementariamente la TC de base de cráneo-cuello en todos los PGLs yugulares o yugulotimpánicos y solo en los PGLs vagales o carotídeos que estén próximos a la base del cráneo.
2. 18F-FDOPA PET-TC.
ó
68Ga-DOTATATE PET-TC (se prefiere si está disponible).
La sociedad Británica de Base de Cráneo (1) recomienda realizar preferiblemente RM de tórax-abdomen-pelvis (imágenes coronales ponderadas en T1 y STIR de todo el cuerpo y secuencias axiales ponderadas en T2 de saturación de grasa desde la base del cráneo hasta los riñones) como parte de este estudio de multicentricidad y reconocen como opción el 68Ga-DOTATATE PET-TC. Sin embargo, las imágenes funcionales con PET-TC han demostrado mayor eficacia en la detección de PGLs que las pruebas de imagen anatómicas. El 68Ga-DOTATATE PET-TC propuesto como alternativa no está disponible en la mayoría de los centros españoles aunque es la mejor opción.
El 18F- FDOPA PET-TC, aunque no ha sido mencionado en este consenso británico, ha demostrado en numerosas publicaciones ser una excelente opción y está disponible generalmente. Por este motivo, como se observa en la Figura 1., nosotros recomendamos realizar al diagnóstico el 18F-FDOPA PET-TC frente a la RM dado que es más sensible, más específico y requiere menor tiempo en la adquisión de las imágenes. Sus ventajas e inconvenientes se discutirán más profundamente a continuación en el apartado “Resultados”.
PRUEBAS DURANTE EL SEGUIMIENTO
1. DETERMINACIÓN DE METANEFRINAS
Solo realizamos determinación de metanefrinas anualmente si en algún momento fue un tumor secretor, se trata de PGLs multicéntricos o en pacientes con estudio genético positivo (1). En el resto de los casos, no se estudia periódicamente la producción de metanefrinas.
Si la determinación de metanefrinas se eleva, hay que realizar un rastreo corporal en dicho momento preferiblemente con 18F-FDOPA PET-TC o 68Ga-DOTATATE PET-TC. No obstante, debemos de saber que un tumor inicialmente no secretor puede volverse secretor con el tiempo.
2. PRUEBAS DE IMAGEN
Durante el seguimiento deben de realizarse las siguientes pruebas de imagen con el objetivo de detectar la aparición de recurrencias locales, metástasis o nuevos tumores (8):
1. RM de cabeza y cuello: anualmente.
Existen algunas excepciones:
- Si ha sido intervenido se debe realizar un control postquirúrgico idealmente antes de los 6 meses para descartar persistencia.
- Este intervalo se puede aumentar para los tumores que se han mantenido estables.
- El seguimiento radiológico puede ser detenido en pacientes de edad avanzada con tumores estables aislados.
- Los PGLs aislados tratados con resección total y con estudio genético negativo pueden finalizar el seguimiento con RM de cabeza y cuello tras 5 años. La Sociedad Británica de Base de Cráneo [1] propone incluso que sean dados de alta a los 5 años (aunque esto no aplica para los PGLs yugulares).
2. 18F-FDOPA PET-TC: cada 3 años.
ó
68Ga-DOTATATE PET-TC (se prefiere si está disponible): cada 3 años.
Existen algunas excepciones:
- PGLs aislados con estudio genético negativo y con prueba de imagen corporal al diagnóstico negativa no requieren más rastreo corporal tras 5 años de seguimiento (8). La Sociedad Británica de Base de cráneo (1) establece que puede finalizarse el rastreo corporal desde que es negativo al diagnóstico.
- Este intervalo se puede reducir en formas familiares con alta expresividad o penetrancia mutacional.
- El seguimiento radiológico puede ser detenido en pacientes de edad avanzada con tumores estables aislados.
La Sociedad Británica de base de cráneo (1) propone la RM tórax-abdomen-pelvis cada 3 años como prueba de imagen de rastreo corporal durante el seguimiento y propone la ECO abdominal anual en pacientes con mutaciones SDHB para detectar precozmente el carcinoma de células renales. En este sentido, aunque ya hemos anticipado por qué preferimos realizar 18F-DOPA PET-TC, reconocemos el concepto de vigilancia en el que nos encontramos. Por este motivo, hemos de tener en cuenta la radiación que recibe el paciente especialmente en pacientes jóvenes en los que se espera un largo periodo de seguimiento. En estos casos, reconocemos la alternativa de poder alternar la RM corporal con las imágenes funcionales durante el seguimiento.
PRUEBAS DE CRIBADO A FAMILIARES
Debe realizarse el estudio de metanefrinas y el estudio genético en cascada a los familiares de aquellos pacientes con mutaciones conocidas del panel, salvo en los portadores de mutaciones SDHD/SDHAF2 por vía materna. Solo deberemos plantear el seguimiento clínico y radiológico a aquellos familiares en los que se confirme la mutación índice.
Existen pacientes con PGLs que tienen variantes de significado incierto en el estudio del panel genético. Se considera que no hay indicación para evaluar a los familiares si el paciente no tiene otros factores de riesgo de enfermedad hereditaria, es decir, tumor aislado, edad >30 años o antecedentes familiares.
Hay una variedad de opiniones sobre cuándo debe comenzar el rastreo corporal y el seguimiento periódico con pruebas de imagen, con algunos autores sugiriendo un comienzo más temprano (1) y otros más tardío (21). Nuestra opinión es que el objetivo es detectar tumores en una etapa temprana, pero a una edad en la que solamos plantear un tratamiento activo. En nuestro centro, si los pacientes con mutaciones se encuentran asintomáticos no comenzamos el cribado hasta los 20 años. Es posible que sea la condición más variable y menos establecida en nuestro caso pues existen familias con alta expresividad genética y desarrollo tumoral temprano en los que adelantamos el inicio del seguimiento. La Sociedad Británica de Base de Cráneo (1) propone la edad de comienzo de 15 años para el estudio radiológico.
Las pruebas de cribado y seguimiento recomendadas no difieren según el manejo terapéutico que se haya decidido para cada paciente.
Las principales recomendaciones concretas son (1):
- Si se realiza resección total el primer control radiológico con RM sería idealmente antes de los 6 meses, a las 8-12 semanas tras la cirugía.
- Si se realiza resección total de un PGL secretor la determinación de metanefrinas en plasma sería idealmente antes del año, a las 2-6 semanas tras la cirugía.
Las recomendaciones resumidas aquí son una guía útil en el seguimiento y cribado familiar de pacientes con PGLs de cabeza y cuello. Aunque la mayoría de las recomendaciones hasta la fecha se basan en la opinión de expertos, estandarizar en la medida de lo posible el seguimiento de estos pacientes permitirá analizar los resultados. Por ello, siguiendo estas recomendaciones, el siguiente paso sería estudiar las tasas de control tumoral, la necesidad de tratamiento adicional, las tasas de preservación de pares craneales, la tasa de complicaciones, el cumplimiento de las pautas de manejo y la calidad de vida de los pacientes, entre otros.
Especial mención merecen las pruebas de imagen a realizar durante el seguimiento de estos pacientes o de sus familiares. Una de las principales ventajas de las imágenes metabólicas es permitir el examen de todo el cuerpo, lo cual es muy útil para la detección de formas multifocales, y diferenciar entre tejido cicatricial y tumoral. Estas pruebas, que utilizan radiotrazadores que dependen del metabolismo y la secreción de catecolaminas, el metabolismo de la glucosa o el estado del receptor de somatostatina tumoral, han demostrado una sensibilidad y especificidad superior a las pruebas de imagen anatómicas, como la TC o la RM, pero, debido al contexto de vigilancia en el que nos hallamos, limitar la radiación al paciente también es una cuestión de suma importancia. Por dicho motivo, reconocemos como la mejor opción disponible el 18F-FDOPA PET/TC pero entendemos la alternativa de optar por realizar RM de tórax-abdomen-pelvis durante el seguimiento o alternar ambas pruebas.
La gammagrafía con distintos radioisótopos como 123I-metayodobencilguanidina (MIBG), 131I-MIBG, 111In-octreótide (OctreoScan®) se ha usado mucho a lo largo de la historia, pero su sensibilidad en la detección de PGLs de cabeza y cuello (o extraadrenales), metastásicos y recurrentes generalmente es baja (especialmente en tumores <1cm) por lo que ha sido reemplazada en gran medida por técnicas más nuevas (22-25).
Actualmente el PET-TC con péptidos marcados con 68Ga a través de un quelante (DOTA) (DOTATOC [Tyr3-octreotida], DOTATATE [Tyr3-octreotato], DOTANOC [Nal3-octreotida]) se ha convertido en la modalidad de imagen funcional de primera línea en la evaluación de los PGLs de cabeza y cuello, independientemente de los antecedentes genéticos, con una sensibilidad y especificidad del 100% (1,25). Como en todas las pruebas de imagen funcionales, se pueden observar resultados falsos positivos, como ganglios linfáticos metastásicos de cáncer de tiroides, ciertos cánceres de cabeza y cuello y especialmente en meningiomas.
No obstante, aunque hay un aumento creciente de su uso en Estados Unidos, el uso de estos marcadores aún no está disponible en la mayoría de los centros españoles. Por este motivo, hay que valorar otras técnicas de imagen en nuestro país. Muchos estudios han demostrado que 18F-FDOPA PET-TC es un excelente examen de primera línea para la detección de formas multifocales en el contexto de PGLs de cabeza y cuello (tanto SDHx como no SDHx) con una sensibilidad y especificidad cercana al 100% (6,25).
En los PGLs en general, se observa un mayor grado de captación de 18F-FDG en PGLs asociados con SDHx (especialmente SDHB [26]) y VHL y un mayor grado de captación de 18F-DOPA PET-TC en PGLs asociados a MEN2 o NF1. Se correlacionan con grupos mutacionales y fisiopatológicos impulsados por pseudohipoxia (SDHx y VHL) o por señalización de quinasas (MEN2 y NF1) (6,23,27). Estos hallazgos ilustran la existencia de correlaciones radiográficas de genotipo y fenotipo en pacientes con PGLs que quizá puedan llegar a cambiar en el futuro la elección de las técnicas radiológicas según el genotipo (23,28). No obstante, el 18F- FDG PET-TC no es la modalidad preferida, en general, por su menor especificidad.
La principal complicación que encontramos es la heterogeneidad de protocolos o la usencia de estos en los diferentes centros. Derivado de esto, existe la dificultad de analizar los resultados de estos protocolos que nos permitirían establecer recomendaciones firmes y adaptadas al riesgo de cada paciente para garantizar que todos reciben la atención adecuada.
Además, debido a la complejidad de la enfermedad, es necesario un equipo multidisciplinar con amplia experiencia en la gestión de PGLs recomendándose al menos incluir dentro de este equipo a ORLs, oncólogos, especialistas en genética clínica, endocrinólogos, cirujanos vasculares, radiólogos y patólogos.
BIBLIOGRAFÍA
- Lloyd S, Obholzer R, Tysome J; BSBS Consensus Group. British Skull Base Society Clinical Consensus Document on Management of Head and Neck Paragangliomas. Otolaryngol Head Neck Surg. 2020;163(3):400-9.
- Suárez C, Rodrigo JP, Ferlito A, Cabanillas R, Shaha AR, Rinaldo A. Tumours of familial origin in the head and neck. Oral Oncol. 2006; 42(10):965-78.
- National Comprehensive Cancer Network. Clinical practice guidelines in oncology: neuroendocrine tumours. http://www.nccn.org. Published 2016.
- Lenders JW, Duh QY, Eisenhofer G, et al. Pheochromocytoma and paraganglioma: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2014;299:1915-42.
- Chen H, Sippel RS, O’Dorisio MS, Vinik AI, Lloyd RV, Pacak K. The North American Neuroendocrine Society consensus guideline for the diagnosis and management of neuroendocrine tumors: phaeochromocytoma, paraganglioma and medullary thyroid cancer. Pancreas. 2010;39:775-83.
- Taieb D, Timmers HJ, Hindie E, et al. EANM 2012 guidelines for radionuclide imaging of phaeochromocytoma and paraganglioma. Eur J Nucl Med Mol Imaging. 2012;39:1977-95.
- Plouin PF, Amar L, Dekkers OM, et al. European Society of Endocrinology clinical practice guideline for long-term followup of patients operated on for phaeochromocytoma or a paraganglioma. Eur J Endocrinol. 2016;174:G1-G10.
- Llorente Pendas JL, Polo López R, Viscasillas Pallás G, Viña Soria C, Sánchez Fernández P. 2020. Paragangliomas de cabeza y cuello. Sociedad Española de Otorrinolaringología y Cirugía de Cabeza y Cuello. Actualización en Otorrinolaringología y Cirugía de Cabeza y Cuello [Internet]. Barcelona. http://www.actualizacion.seorl.net/article?id=5e58d80d-a400-4b5f-be8e-1daf0aca0137.).
- Jansen TTG, Timmers HJLM, Marres HAM, et al. Feasibility of a wait-and-scan period as initial management strategy for head and neck paraganglioma. Head Neck. 2017;39:2088-94.
- Amar L, Lussey-Lepoutre C, Lenders JW, Djadi-Prat J, Plouin PF, Steichen O. Management of endocrine disease: Recurrence or new tumors after complete resection of pheochromocytomas and paragangliomas: a systematic review and meta-analysis. Eur J Endocrinol. 2016;175(4):R135-45.
- Plouin PF, Fitzgerald P, Rich T, Ayala-Ramirez M, Perrier ND, Baudin E & Jimenez C. Metastatic pheochromocytoma and paraganglioma: focus on therapeutics. Hormone and Metabolic Research. 2012;44: 390–9.
- Hozo SP, Djulbegovic B & Hozo I. Estimating the mean and variance from the median, range, and the size of a sample. BMC Medical Research Methodology.2005; 5:13.
- Wan X, Wang W, Liu J & Tong T. Estimating the sample mean and standard deviation from the sample size, median, range and/or interquartile range. BMC Medical Research Methodology. 2014;14:135.
- Agarwal G, Sadacharan D, Aggarwal V, Chand G, Mishra A, Agarwal A, Verma AK & Mishra SK. Surgical management of organ-contained unilateral pheochromocytoma: comparative outcomes of laparoscopic and conventional open surgical procedures in a large singleinstitution series. Langenbeck’s Archives of Surgery. 2012; 397:1109-16.
- Schovanek J, Martucci V, Wesley R, Fojo T, Del Rivero J, Huynh T, Adams K, Kebebew E, Frysak Z, Stratakis CA, Pacak K. The size of the primary tumor and age at initial diagnosis are independent predictors of the metastatic behavior and survival of patients with SDHB-related pheochromocytoma and paraganglioma: a retrospective cohort study. BMC Cancer. 2014;14:523.
- Gimenez-Roqueplo AP, Favier J, Rustin P, Rieubland C, Crespin M, Nau V, Khau Van Kien P, Corvol P, Plouin PF, Jeunemaitre X; COMETE Network. Mutations in the SDHB gene are associated with extra-adrenal and/or malignant phaeochromocytomas. Cancer Res. 2003;63(17):5615-21.
- Neumann HP, Pawlu C, Peczkowska M, Bausch B, McWhinney SR, Muresan M, Buchta M, Franke G, Klisch J, Bley TA, Hoegerle S, Boedeker CC, Opocher G, Schipper J, Januszewicz A, Eng C; European-American Paraganglioma Study Group. Distinct clinical features of paraganglioma syndromes associated with SDHB and SDHD gene mutations. JAMA. 2004;292(8):943-51.
- Amar L, Baudin E, Burnichon N, Peyrard S, Silvera S, Bertherat J, Bertagna X, Schlumberger M, Jeunemaitre X, Gimenez-Roqueplo AP, Plouin PF. Succinate dehydrogenase B gene mutations predict survival in patients with malignant pheochromocytomas or paragangliomas. J Clin Endocrinol Metab. 2007;92(10):3822-8.
- Papathomas TG, de Krijger RR, Tischler AS. Paragangliomas: update on differential diagnostic considerations, composite tumors and recent genetic developments. Semin Diagn Pathol. 2013;30:207-23.
- NGS in PPGL Study Group; Toledo RA, Burnichon N, Cascon A, et al. Consensus statement on next-generation-sequencingbased diagnostic testing of hereditary phaeochromocytomas and paragangliomas. Nat Rev Endocrinol. 2017;13:233-47.
- Eijkelenkamp K, Osinga TE, de Jong MM, et al. Calculating the optimal surveillance for head and neck paraganglioma in SDHB-mutation carriers. Fam Cancer. 2017;16:123-30.
- Bhatia KS, Ismail MM, Sahdev A, et al. 123I-metaiodobenzyl-guanidine (MIBG) scintigraphy for the detection of adrenal and extra-adrenal phaeochromocytomas: CT and MRI correlation. Clin Endocrinol Oxf. 2008;69:181–8.
- Wiseman GA, Pacak K, O’Dorisio MS, et al. Usefulness of 123I-MIBG scintigraphy in the evaluation of patients with known or suspected primary or metastatic pheochromocytoma or paraganglioma: results from a prospective multicenter trial. J Nucl Med. 2009;50:1448–54.
- Timmers HJ, Chen CC, Carrasquillo JA, et al. Comparison of 18F-fluoro-L-DOPA, 18F-fluoro-deoxyglucose, and 18F-fluorodopamine PET, and 123I-MIBG scintigraphy in the localization of pheochromocytoma and paraganglioma. J Clin Endocrinol Metab. 2009;94:4757–67.
- Guichard JP, Fakhry N, Franc J, Herman P, Righini CA, Taieb D. Morphological and functional imaging of neck paragangliomas. Eur Ann Otorhinolaryngol Head Neck Dis. 2017;134(4):243-8.
- Rao AB, Koeller KK, Adair CF. From the archives of the AFIP. Paragangliomas of the head and neck: radiologic-pathologic correlation. Armed Forces Institute of Pathology. Radiographics. 1999;19(6):1605-32.
- Nölting S, Grossman AB. Signaling pathways in pheochromocytomas and paragangliomas: prospects for future therapies. Endocr Pathol. 2012;23(1):21-33.
- Tiwari A, Shah N, Sarathi V, Malhotra G, Bakshi G, Prakash G, Khadilkar K, Pandit R, Lila A, Bandgar T. Genetic status determines 18 F-FDG uptake in pheochromocytoma/paraganglioma. J Med Imaging Radiat Oncol. 2017;61(6):745-52.
 Pasar al contenido principal
Pasar al contenido principal