La glándula tiroidea tiene dos tipos principales de células:


1. Las células foliculares usan yodo de la sangre para producir la hormona tiroidea que ayuda a regular el metabolismo. La cantidad de hormona tiroidea segregada por la tiroides es regulada por la hipófisis, en la base del cerebro, que produce una sustancia llamada hormona estimulante de tiroides (TSH).
2. Las células C (también llamadas células parafoliculares) producen calcitonina, una hormona que ayuda a controlar cómo el cuerpo usa el calcio.
3. Otras células menos comunes en la glándula tiroidea incluyen las células del sistema inmunitario (linfocitos) y las células de apoyo (estromales).
Cada tipo de célula genera diferentes tipos de cáncer. Las diferencias son importantes porque afectan a cuán grave es el cáncer y el tipo de tratamiento que se necesita:
- Diferenciados (incluyendo papilar, folicular y célula Hurthle)
- Medular
- Anaplásico (un agresivo tumor indiferenciado)
A) CÁNCER DE TIROIDES DIFERENCIADOS:
La mayoría de los cánceres de tiroides son diferenciados. Las células de estos cánceres se parecen mucho al tejido normal de la tiroides y se originan en las células foliculares:
1. Cáncer papilar:
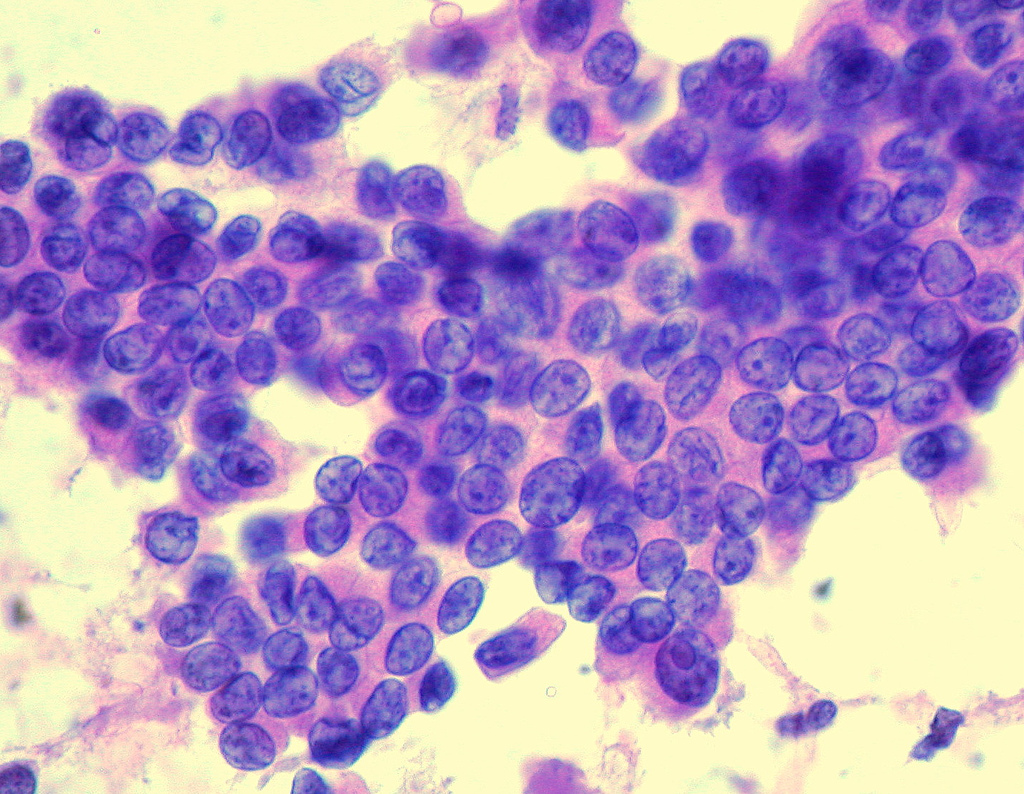
Aproximadamente ocho de cada 10 cánceres de tiroides son cánceres papilares Suelen crecer muy lentamente, y por lo general se originan en un solo lóbulo de la glándula tiroides. A pesar de que crecen lentamente, los cánceres papilares a menudo se propagan a los ganglios linfáticos en el cuello. Hay varios subtipos de cánceres papilares. De estos, el subtipo folicular (también llamado variante folicular-papilar mixta) ocurre con más frecuencia. Otros subtipos de carcinoma papilar (células altas, células cilíndricas y esclerosante difuso e insular) no son tan comunes y tienden a crecer y a propagarse más rápidamente.
2. Cáncer folicular:

Es el más común en los países donde las personas no reciben suficiente yodo en la alimentación. Por lo general, estos cánceres no se propagan a los ganglios linfáticos, aunque se pueden propagar a otras partes del cuerpo, tal como los pulmones o los huesos. Probablemente, el pronóstico para el cáncer folicular no es tan favorable en la mayoría delos casos.
3. Cáncer de células Hürthle:

Este tipo también se conoce como carcinoma de células oxífilas. Alrededor del 3% de los cánceres de tiroides son de este tipo que es más difícil de tratar.
4. Cáncer medular:
Representa aproximadamente un 4% de los cánceres de tiroides. Se origina de las células C de la glándula tiroides que normalmente produce calcitonina, Algunas veces este cáncer se puede propagar a los ganglios linfáticos, los pulmones o al hígado, incluso antes de que se detecte un nódulo tiroideo.
Este tipo de cáncer de tiroides es más difícil de descubrir y tratar.
Tipos de cáncer medular tiroideo:
- El MTC esporádico representa aproximadamente ocho de cada 10 casos de MTC, y no es hereditario (no tiende a darse entre las personas de una misma familia). Este cáncer ocurre principalmente en adultos de edad avanzada y afecta únicamente a un lóbulo tiroideo.
- El MTC familiar es hereditario y entre 20% y 25% puede surgir en cada generación de una familia. A menudo, estos cánceres se desarrollan durante la infancia y se pueden propagar temprano.
El MTC familiar a menudo está asociado con un riesgo aumentado de otros tipos de tumores.
B) CÁNCER DE TIROIDES INDIFERENCIADO O ANAPLÁSICO.
Es una forma poco común de cáncer de tiroides, representando alrededor de 2% de todos los cánceres de tiroides. Se cree que algunas veces se origina del cáncer papilar o folicular que ya está presente. A este cáncer se le llama indiferenciado debido a que las células cancerosas no se parecen mucho a las células normales de la tiroides al observarlas con el microscopio. Este cáncer a menudo se propaga rápidamente hacia el cuello y otras partes del cuerpo, y es muy difícil de tratar.


C) Cánceres de tiroides menos frecuentes
Menos del 4% de los cánceres en la tiroides son linfomas de tiroides, sarcomas de tiroides u otros tumores poco comunes.
ETIOLOGÍA-FISIOPATOGENIA
El cáncer de tiroides está asociado con varias afecciones hereditarias aunque no se conoce aún la causa exacta de la mayoría de los cánceres. Ciertos cambios en el ADN pueden causar que las células de la tiroides se hagan cancerosas.

1. Cáncer papilar de tiroides:
Se han descubierto varias mutaciones (cambios) de ADN en el cáncer papilar de tiroides. Muchos de estos cánceres tienen cambios en partes específicas del gen RET. La forma alterada de este gen, conocida como oncogén PTC se encuentra, en general, entre alrededor del 10% al 30% de los cánceres papilares de tiroides, y un porcentaje mayor de estos cánceres en niños y/o están asociados con la exposición a la radiación. Estas mutaciones RET usualmente no son hereditarias, sino que se adquieren durante la vida de una persona. Se encuentran únicamente en las células cancerosas y no se transmiten a los hijos del paciente.
Muchos cánceres papilares de tiroides tienen un gen BRAF mutado. Los cánceres con cambios BRAF suelen crecer y propagarse más rápidamente a otras partes del cuerpo. Los cambios en otros genes también han sido asociados con cáncer papilar de tiroides, incluyendo aquellos en el gen NTRK1 y en el gen MET.
2. Cáncer folicular de tiroides:
Los cambios adquiridos en el oncogen RAS, así como cambios en el reordenamiento PAX8–PPAR-γ, cumplen una función en el origen de algunos cánceres foliculares de tiroides.
3. Cáncer anaplásico de tiroides:
Estos cánceres suelen tener algunas de las mutaciones descritas anteriormente, y a menudo también tienen cambios en el gen supresor de tumores TP53 y en el oncogén CTNNB1.
4. Cáncer medular tiroideo:
Las personas con cáncer medular de tiroides (MTC) tienen mutaciones en diferentes partes del gen RET en comparación con los pacientes que tienen carcinoma papilar.
La probabilidad de ser diagnosticado con cáncer de tiroides ha aumentado en los últimos años. La mayor parte del aumento se debe a un mayor uso de la ecografía de tiroides que puede detectar pequeños nódulos de tiroides que de otra manera no habrían sido estudiados.
Factores de riesgo del cáncer de tiroides
Existen una serie de factores de riesgo inherentes al paciente y que no pueden ser cambiados, y otros que dependen de factores externos, de los que se puede disminuir su influencia tomando una serie de medidas.
Factores de riesgo que no se pueden cambiar :
1. Sexo y edad.
Por razones que no están claras, los cánceres tiroideos (al igual que casi todas las enfermedades de tiroides) ocurren alrededor de tres veces más en las mujeres que en los hombres.
El cáncer de tiroides puede ocurrir a cualquier edad. Sin embargo, para las mujeres (quienes con más frecuencia están en las edades de 40 a 59 años al momento del diagnóstico), el riesgo está en su punto más alto a una edad menor que para los hombres (quienes usualmente están en las edades de 60 a 79 años).
2. Enfermedades hereditarias
Varias afecciones hereditarias se han asociado con diferentes tipos de cáncer de tiroides. Aun así, la mayoría de las personas que padece cáncer de tiroides no presenta una afección hereditaria o un antecedente familiar de la enfermedad.
- Cáncer medular tiroideo: aproximadamente 8 de cada 10 carcinomas medulares de tiroides resulta como consecuencia de heredar un gen anormal (FMTC). El FMTC puede ocurrir solo, o puede ser visto junto con otros tumores.
La combinación de FMTC con tumores de otras glándulas endocrinas se conoce como neoplasia endocrina múltiple tipo 2 (MEN 2). Existen dos subtipos, la MEN 2a y la MEN 2b:
Ambos son causados por mutaciones (defectos) en un gen llamado RET.
- En la MEN 2a, el carcinoma medular de tiroides ocurre con los feocromocitomas y con los tumores de las glándulas paratiroides.
- En la MEN 2b, el carcinoma medular de tiroides está asociado con los feocromocitomas y con los crecimientos benignos de los tejidos nerviosos en la lengua y en otros lugares llamados neuromas. Este subtipo es mucho menos común que el MEN 2a.
En estas formas hereditarias del carcinoma medular de tiroides, los cánceres a menudo se generan durante la infancia o en adultos jóvenes y se pueden propagar tempranamente. El carcinoma medular de tiroides es más agresivo en el síndrome MEN 2b.

Otros cánceres de tiroides:
Las personas con ciertas afecciones médicas hereditarias tienen un mayor riesgo de formas más comunes de cáncer de tiroides. Se observan tasas más altas de cáncer de tiroides en aquellas personas con afecciones genéticas poco comunes, tales como:
- Poliposis adenomatosa familiar-Síndrome de Gardner es un subtipo de la enfermedad anterior, en el que los pacientes también tienen ciertos tumores benignos. Tanto el síndrome de Gardner, como la FAP son causados por defectos en el gen APC.
- Enfermedad de Cowden: las personas con este síndrome tienen un riesgo aumentado de problemas con la tiroides y ciertos crecimientos benignos (hamartomas). También tienen un riesgo aumentado de padecer cánceres de tiroides, útero, mama, así como algunos otros. Los cánceres de tiroides tienden a ser del tipo papilar o folicular. Este síndrome es causado con más frecuencia por defectos en el gen PTEN.
- Complejo de Carney, tipo I: las personas que padecen este síndrome pueden presentar un número de tumores benignos y problemas hormonales. También tienen un riesgo aumentado de padecer cáncer papilar y folicular. Este síndrome es causado por defectos en el gen PRKAR1A.
- Carcinoma familiar de tiroides no medular: el cáncer de tiroides ocurre con más frecuencia en algunas familias, y a menudo se observa a una edad más temprana. A menudo, el tipo de cáncer papilar de tiroides suele ocurrir entre las personas de una misma familia. Se sospecha que los genes que se encuentran en el cromosoma 19 y en el cromosoma 1 causan estos cánceres familiares.
3. Antecedentes familiares.
El riesgo de cáncer de tiroides aumenta al tener un pariente de primer grado con cáncer de tiroides. Las bases genéticas para estos cánceres no están totalmente claras.
Factores de riesgo que se pueden cambiar :
1. Alimentación baja en yodo.
Los cánceres foliculares de tiroides son más comunes en algunas áreas del mundo en las que las dietas son bajas en yodo.
2. Radiación.
La exposición a la radiación es un factor de riesgo probado para el cáncer de tiroides. Las fuentes de tal radiación incluyen ciertos tratamientos médicos y precipitación radiactiva de las armas nucleares o accidentes centrales nucleares.
1. DIAGNÓSTICO PRECOZ:
La mayoría de los cánceres de tiroides en etapa inicial se detecta cuando los pacientes han notado una masa en el cuello.
No hay ninguna prueba de detección recomendada para encontrar temprano el cáncer de tiroides.
Algunas veces, los cánceres de tiroides también se detectan cuando la gente se somete a estudios de ecografía debido a otros problemas de salud.
Los análisis de sangre o la ecografía de la tiroides a menudo pueden encontrar cambios en la tiroides, pero estas pruebas no son recomendadas como pruebas de detección para el cáncer de tiroides a menos que una persona tenga un mayor riesgo, tal como antecedente familiar de cáncer de tiroides.
Las personas con antecedentes familiares de cáncer medular de tiroides (MTC), con o sin neoplasia endocrina múltiple tipo 2 (MEN 2), podrían estar en alto riesgo de padecer este cáncer. La mayoría de los médicos recomienda pruebas genéticas para estas personas cuando son jóvenes para ver si tienen los cambios genéticos asociados con el MTC.
2. DIAGNÓSTICO CLÍNICO:
El cáncer de tiroides puede causar cualquiera de los siguientes signos o síntomas:
- Un bulto o masa en el cuello que algunas veces crece rápidamente.
- Inflamación en el cuello
- Dolor en la parte frontal del cuello que algunas veces alcanza hasta los oídos
- Ronquera u otros cambios en la voz que persisten
- Problemas de deglución
- Dificultad para respirar
- Tos constante
1. PAAF
El diagnóstico definitivo de cáncer de tiroides se hace con una biopsia por aspiración, casi siempre bajo control ecográfico, en la que se obtienen células del área sospechosa.
Por lo general, se debe realizar esta prueba en todos los nódulos tiroideos que son más grandes de un centímetro o que cumplen otras características ecográficas que nos hacen sospechar malignidad.
2. Estudios por imágen
Ecografía:
Este estudio puede ayudar a determinar si un nódulo tiroideo es sólido o quístico (los nódulos sólidos tienen más probabilidad de ser cancerosos). También se puede usar para examinar la cantidad y el tamaño de los nódulos tiroideos. Puede a veces sugerir si es probable que sea canceroso, aunque una ecografía no puede indicar con seguridad si es maligno.
Gammagrafías con yodo radiactivo:
A menudo, se usan también en personas que ya han sido diagnosticadas con cáncer tiroideo diferenciado para ayudar a mostrar si se ha propagado. Debido a que las células del cáncer medular de tiroides no absorben el yodo, no se usan las gammagrafías con yodo radiactivo en este cáncer.

Las áreas anormales de la glándula tiroides que contienen menos radioactividad que el tejido circundante se llaman nódulos fríos, y las áreas que atraen más radiación se llaman nódulos calientes. Por lo general, los nódulos calientes no son cancerosos, pero los nódulos fríos pueden ser benignos o cancerosos. Debido a que tanto los nódulos benignos como los cancerosos pueden aparecer fríos, esta prueba no puede diagnosticar por sí sola el cáncer de tiroides.
Después de la cirugía para cáncer de tiroides, las gammagrafías con yodo radiactivo de todo el cuerpo son útiles para detectar una posible propagación por todo el cuerpo. Estos estudios se vuelven incluso más sensibles si toda la glándula tiroidea ha sido extirpada mediante cirugía porque más yodo radiactivo es recogido por cualquier célula del cáncer tiroideo remanente.
Las gammagrafías con yodo radiactivo funcionan mejor si los pacientes tienen niveles altos de la hormona estimulante de tiroides (TSH) Para las personas que han sido sometidas a un a tiroidectomía, se pueden aumentar los niveles de TSH al suspender las pastillas de hormona tiroidea por varias semanas antes del estudio. Esto causa niveles bajos de hormona tiroidea (hipotiroidismo), haciendo que la glándula pituitaria segregue más TSH, lo que estimula a cualquier célula de cáncer de tiroides a absorber el yodo radiactivo. Una desventaja de esto consiste en que puede causar los síntomas de hipotiroidismo, incluyendo cansancio, depresión, aumento de peso, somnolencia, estreñimiento, dolores musculares y dificultad para concentrarse.
Una manera de aumentar los niveles de TSH sin suspender el tratamiento sustitutivo de hormona tiroidea es administrar una forma inyectable de tirotropina (Thyrogen®) antes del estudio.
Tomografía computarizada:
La TC puede ayudar a determinar la localización y el tamaño de los cánceres de tiroides y si ellos se han propagado a áreas cercanas, aunque la ecografía es el estudio que usualmente se hace.
Una desventaja de la CT es que la sustancia de contraste de la CT contiene yodo, lo que interfiere con las gammagrafías con yodo radiactivo. Por esta razón, muchos médicos prefieren las imágenes por resonancia magnética para el cáncer diferenciado de tiroides.
Resonancia magnética:
Al igual que la tomografía computarizada, la resonancia magnética se pueden usar para saber si hay cáncer en la tiroides, o aquel cáncer que se ha propagado a partes cercanas o distantes del cuerpo.
Tomografía por emisión de positrones:
La tomografía por emisión de positrones (PET) puede ser muy útil si el cáncer de tiroides no absorbe yodo radiactivo. En este caso, la PET puede indicar para valorar una posible extensión del cáncer.
3. CLASIFICACIÓN
Sistema de clasificación por etapas TNM del American Joint Committee on Cancer (AJCC):
Categorías T del cáncer de tiroides (excepto cáncer de tiroides anaplásico)
- TX: no se puede evaluar el tumor primario.
- T0: no hay evidencia de tumor primario.
- T1: el tumor mide 2 cm o menos y no ha crecido fuera de la tiroides.
- T1a: el tumor mide1 cm o más pequeño, y no ha crecido fuera de la tiroides.
- T1b: el tumor mide más de 1 cm, pero no mide más de 2 cm y no ha crecido fuera de la tiroides.
- T2: el tumor mide más de 2 cm, pero no más de 4 cm y no ha crecido fuera de la tiroides.
- T3: el tumor mide más de 4 cm de ancho, o ha comenzado a crecer en los tejidos adyacentes fuera de la tiroides.
- T4a: el tumor es de cualquier tamaño y ha crecido más allá de la glándula tiroidea hacia los tejidos adyuvantes del cuello, tal como la laringe, la tráquea, el esófago o al nervio laríngeo inferior
- T4b: el tumor es de cualquier tamaño y ha crecido de nuevo hacia la columna vertebral o hacia los vasos sanguíneos grandes adyacentes.
Categorías T del cáncer de tiroides anaplásico
Todos los cánceres tiroideos anaplásicos se consideran tumores T4 al momento del diagnóstico.
- T4a: el tumor aún se encuentra confinado en la tiroides.
- T4b: el tumor creció fuera de la tiroides.
Categorías N del cáncer de tiroides
- NX: no se pueden evaluar los ganglios linfáticos regionales N0: el cáncer no se ha propagado a los ganglios linfáticos cervicales.
- N1: el cáncer se ha propagado a los ganglios linfáticos cervicales.
- N1a: el cáncer se propagó a los ganglios linfáticos alrededor de la tiroides en el cuello (llamados ganglios linfáticos pretraqueales, paratraqueales y prelaríngeos).
- N1b: el cáncer se propagó a otros ganglios linfáticos en el cuello o a ganglios linfáticos ubicados detrás de la garganta (retrofaringeales) o en la parte superior del tórax (mediastino superior).
Categorías M del cáncer de tiroides
- MX: no se puede evaluar la metástasis a distancia.
- M0: no hay metástasis distante.
- M1: el cáncer se propagó a otras partes del cuerpo, tal como ganglios linfáticos distantes, órganos internos, huesos, etc.
Una vez que se determinan los valores para la T, N y M, éstos se combinan en grados, expresadas en un número romano del I al IV.
Al contrario a la mayoría de los cánceres, los cánceres de tiroides se agrupan en grados de una forma en la que también se toma en cuenta el subtipo de cáncer y la edad del paciente.
Cáncer papilar o folicular de tiroides (diferenciado):
Pacientes menores de 45 años: Los pacientes más jóvenes tienen menores probabilidades de morir a causa del cáncer tiroideo diferenciado (papilar o folicular). Por lo tanto, todas las personas menores de 45 años con estos cánceres se clasifican en grado I si no tienen propagación a distancia y grado II si hay propagación a distancia.
4. SUPERVIVENCIA: Tasas de supervivencia del cáncer de tiroides por tipo y grado.
Las siguientes estadísticas de supervivencia fueron publicadas en la séptima edición del AJCC Cancer Staging Manual en el 2010, y están basadas en la etapa del cáncer cuando la persona fue inicialmente diagnosticada con la enfermedad.
Cáncer papilar de tiroides* Etapa Tasa relativa de supervivencia a 5 años I Casi 100% II Casi 100% III 93% IV 51% *Las cifras se basan en pacientes diagnosticados desde 1998 a 1999.
Cáncer folicular de tiroides* Etapa Tasa relativa de supervivencia a 5 años I Casi 100% II Casi 100% III 71% IV 50% *Las cifras se basan en pacientes diagnosticados desde 1998 a 1999. Cáncer medular tiroideo** Etapa Tasa relativa de supervivencia a 5 años I Casi 100% II 98% III 81% IV 28% **Las cifras se basan en pacientes diagnosticados desde 1985 a 1991.
Cáncer anaplásico de tiroides La tasa relativa de supervivencia a 5 años para los carcinomas anaplásicos (indiferenciados), los cuales se consideran todos como etapa IV, es de aproximadamente 7% (basándose en pacientes diagnosticados entre 1985 y 1991).
Las opciones de tratamiento para el cáncer de tiroides pueden incluir:
- Cirugía
- Tratamiento con yodo radiactivo
- Terapia de hormona tiroidea
- Radioterapia con haces externos
- Quimioterapia
- Terapia dirigida
A menudo se combinan dos o más de estas opciones de tratamiento.
Cirugía
La cirugía es el tratamiento principal en casi todos los casos, excepto para algunos cánceres anaplásicos de tiroides.
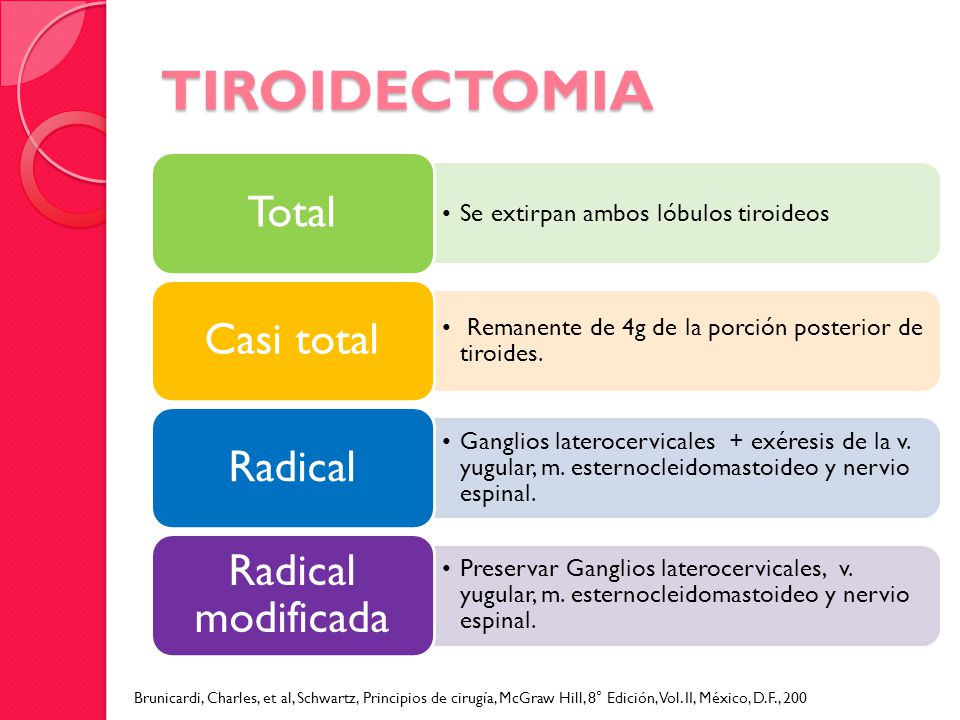
Hay dos tipos principales, la tiroidectomía parcial (hemitiroidectomia) y la tiroidectomía total. Pueden asociar o no un tratamieno quirúrgico para los ganglios cervicales. Otros tipos de cirugía sobre la glándula no deben ser considerados.
HEMITIROIDECTOMIA
Esta cirugía algunas veces se usa para tratar los cánceres de tiroides diferenciados (papilar o folicular) que son pequeños (hay cierta controversia sobre el tamaño, aunque se suele aceptar que sean menores de 1 cm) y que no muestran ningún signo de propagación más allá de la glándula tiroidea. A veces también se usa para diagnosticar el cáncer de tiroides si el resultado de una PAAF no provee un diagnóstico claro.
Una ventaja de esta cirugía consiste en que es posible que algunos pacientes no tengan que tomar pastillas de hormona tiroidea después de la operación, ya que se deja parte de la glándula. Sin embargo, dejar parte de la tiroides puede interferir con algunas pruebas para determinar si hay cáncer recurrente después del tratamiento, como por ejemplo gammagrafías con yodo radiactivo y análisis de sangre de tiroglobulina.
TIROIDECTOMIA TOTAL
En esta cirugía se extirpa la glándula tiroidea. Esta cirugía es la más común para el cáncer de tiroides.
Después de una tiroidectomía se necesitará tomar pastillas de hormona tiroidea (levotiroxina) diariamente. Sin embargo, una ventaja de esta cirugía sobre la hemitiroidectomía consiste en la mayor facilidad para el seguimiento de una posible recurrencia con gammagrafías con yodo radiactivo y análisis de sangre de tiroglobulina.
TRATAMIENTO DE LOS GANGLIOS LINFATICOS.
Si el cáncer se propagó a los ganglios linfáticos adyacentes al cuello, éstos se extirpan al mismo tiempo que se realiza la cirugía en la tiroides. Esto es especialmente importante para el tratamiento contra el cáncer medular de tiroides y el cáncer anaplásico (cuando la cirugía es una opción).
La actitud quirúrgica sobre las adenopatías está actualmente en revisión. La mayoría de los autores consideran contraindicada la extracción de ganglios (picking ganglionar) y creen que se deben realizar vaciamientos completos de las áreas afectadas. Vaciamiento central (área VI) y vaciamientos laterales (II-III-IV-V) según donde estén los ganglios presentes. El vaciamiento electivo, si no hay ganglios afectados macroscópicamente, empieza a ser recomendado siempre para el área VI, estando en discusión si debe o no realizarse sobre los campos laterales según el estadío del tumor.
Las complicaciones son menos probables cuando la operación la realiza un cirujano con experiencia en la cirugía de la glándula tiroides, existen criterios numéricos para valorar la experiencia del cirujano, en general se considera experto si ha realizado más de 500 tiroidectomias y realiza más de 20 al año.
Por lo general, los pacientes que se someten a cirugía de tiroides están listos para dejar el hospital un día o dos después de la operación.
TRATAMIENTO CON YODO RADIOACTIVO
Yodo radiactivo (RAI), también conocido como I-131, se administra al cuerpo en forma de líquido o cápsula, éste se concentra en las células de la glándula tiroides. La radiación puede destruir la glándula tiroides y cualquier otra célula tiroidea (incluyendo las células cancerosas) que absorbe el yodo, con poco efecto en el resto de su cuerpo.
Este tratamiento se puede usar para destruir cualquier tejido tiroideo que no haya sido extirpado mediante cirugía o para tratar algunos tipos de cáncer de tiroides que se hayan propagado a los ganglios linfáticos y a otras partes del cuerpo.
La terapia con yodo radiactivo mejora la tasa de supervivencia de los pacientes con cáncer tiroideo papilar o folicular (o cáncer tiroideo diferenciado) que se ha propagado al cuello o a otras partes del cuerpo, y este tratamiento es actualmente una práctica convencional para dichos casos.
Sin embargo, los beneficios de la terapia con yodo radiactivo son menos claros para los pacientes con cánceres pequeños de la glándula tiroides que no parecen haberse propagado, los cuales que a menudo se pueden extirpar completamente con cirugía.
La terapia con yodo radiactivo no se puede usar para tratar los carcinomas tiroideos anaplásicos (indiferenciados) ni los medulares, ya que estos tipos de cáncer no absorben el yodo.
Para que la terapia con yodo radiactivo sea más eficaz, los pacientes tienen que presentar niveles altos de hormona estimulante de tiroides (TSH o tirotropina) en la sangre. Esta sustancia estimula el tejido de la tiroides (y las células cancerosas) para absorber el yodo radiactivo. Si se extirpó la tiroides, una manera de aumentar los niveles de TSH consiste en no tomar pastillas de hormona tiroidea por varias semanas. Esto provoca niveles muy bajos de hormona tiroidea (una afección conocida como hipotiroidismo), lo que hace que la hipófisis segregue más TSH. Este hipotiroidismo intencional es temporal, pero a menudo puede causar síntomas como cansancio, depresión, aumento de peso, estreñimiento, dolores musculares y dificultad para concentrarse.
Otra manera de aumentar los niveles de TSH antes de la terapia RAI consiste en administrar una forma inyectable de tirotropina (Thyrogen), lo que puede hacer innecesario suspender el reemplazo de hormona tiroidea por un período de tiempo prolongado. Este medicamento se administra diariamente por 2 días, con la RAI el tercer día.
Los efectos secundarios a corto plazo del tratamiento con RAI pueden incluir:
- Hinchazón y dolor al palpar el cuello
- Náuseas y vómitos
- Hinchazón y dolor en las glándulas salivales
- Sequedad bucal
- Cambios en el gusto
Radioterapia
La radiación externa usa rayos (o partículas) de alta energía para destruir las células cancerosas o disminuir su crecimiento.
Generalmente, este tipo de radioterapia no se usa contra cánceres que absorben yodo (esto es, la mayoría de los cánceres de tiroides diferenciados), los cuales se pueden tratar mejor con terapia de yodo radiactivo.
Se usa con más frecuencia como parte del tratamiento del cáncer medular de tiroides y el cáncer anaplásico.
Quimioterapia
En pocas ocasiones, la quimioterapia resulta útil. Uno de los medicamentos más usados es la doxorubicina.
La quimioterapia es combinada con radioterapia externa para el cáncer de tiroides anaplásico, y algunas veces se usa para otros cánceres avanzados que ya no responden a otros tratamientos.
Terapia dirigida
Las investigaciones han estado interesados especialmente en descubrir medicamentos de terapia dirigida para tratar el cáncer de tiroides medular porque los tratamientos de la tiroides a base de hormonas (incluyendo la terapia con yodo radiactivo) no son eficaces contra estos tipos de cáncer.
El vandetanib (Caprelsa® ) es un medicamento dirigido que se administra de forma oral mediante una pastilla una vez al día. En los pacientes con MTC avanzado, el vandetanib detiene el crecimiento de los cánceres por un promedio de alrededor de 6 meses, aunque aún no está claro si aumenta la supervivencia.
El cabozantinib (Cometriq® ) es otro medicamento dirigido usado para tratar el carcinoma medular de tiroides (MTC). Se toma de manera oral (pastillas o tabletas) una vez al día. En pacientes con MTC, el cabozantinib ha demostrado que ayuda a detener el crecimiento de los cánceres por alrededor de 7 meses más que una pastilla de azúcar. Hasta el momento, sin embargo, no ha demostrado que aumente la supervivencia.
Las complicaciones potenciales de la cirugía de tiroides incluyen:
- Ronquera o pérdida de la voz temporal o permanente. Esto puede ocurrir si la laringe o la tráquea está irritada debido al tubo de respiración que se usó durante la cirugía. También puede ocurrir si los nervios de la laringe fueron dañados durante la cirugía. El médico debe examinar las cuerdas vocales antes y después de la cirugía para ver si se mueven normalmente
- Daño a las glándulas paratiroides. Esto puede causar bajos niveles de calcio en la sangre, lo que conduce a espasmos musculares y a sensaciones de entumecimiento y hormigueo.
- Sangrado excesivo o formación de un coágulo sanguíneo mayor en el cuello (hematoma)
- Infección de la herida.
TRATAMIENTO DEL CÁNCER RECURRENTE
El tratamiento del cáncer que regresa después de la terapia inicial depende principalmente del lugar donde está el cáncer, aunque también hay otros factores que pueden ser importantes. Si el cáncer regresa en el cuello, primero se hace una biopsia guiada por ecografía para confirmar que sea realmente cáncer. Luego, si el tumor parece ser resecable a menudo se hace una cirugía. Si el cáncer aparece en la gammagrafía con yodo radiactivo (lo que significa que las células absorben yodo), se puede usar terapia con yodo radiactivo ya sea sola o con cirugía. Por otro lado, si el cáncer no aparece en la gammagrafía con yodo radiactivo, pero aparece en otros estudios por imágenes, como una MRI o PET, se puede usar la radiación externa. Si el cáncer se ha propagado a varios lugares y la terapia RAI no fue útil, primero se intenta la terapia dirigida con sorafenib (Nexavar® y lenvatinib (Lenvima®)
- Ain K, Lee C, Holbrook K, et al. Lenalidomide in distantly metastatic, rapidly progressive and radioiodine unresponsive thyroid carcinomas: Preliminary results. J Clin Oncol. 2008:26(May 20 suppl). Abstract 6027.American Cancer Society; 2016.
- American Joint Committee on Cancer. Thyroid. In: AJCC Cancer Staging Manual. 7th ed. New York, NY: Springer; 2010:87-92.
- American Thyroid Association Guidelines Task Force, Kloos RT, Eng C, Evans DB, et al.
- Medullary thyroid cancer: Management guidelines of the American Thyroid Association. Thyroid. 2015 25;19:567-610.
- American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016; 26:1-133.
- American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016; 26:1-133.
- Brose MS, Nutting CM, Jarzab B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet. 2014 Jul 26;384(9940):319-28. Epub 2014 Apr 24.
- Davidge-Pitts J, Thompson G. Thyroid tumors. In: DeVita VT, Hellman S, Rosenberg SA, eds. DeVita, Hellman, and Rosenberg’s Cancer: Principles and Practice of Oncology. 10th ed. Philadelphia, Pa: Lippincott Williams & Wilkins; 2015.
- Carr LL, Mankoff DA, Goulart BH, et al. Phase II study of daily sunitinib in FDG-PETpositive, iodine-refractory differentiated thyroid cancer and metastatic medullary carcinoma of the thyroid with functional imaging correlation. Clin Cancer Res. 2010;16:5260−5268.
- Cohen E, Rosen L, Vokes E et al. Axitinib is an active treatment for all histologic subtypes of advanced thyroid cancer: Results from a phase II study. J Clin Oncol. 2008;26:4708−4713
- Elisei R, Schlumberger MJ, Müller SP, et al. Cabozantinib in progressive medullary thyroid cancer. J Clin Oncol. 2013 Oct 10;31(29):3639-46. Epub 2013 Sep 3.
- Fagin JA. Challenging dogma in thyroid cancer molecular genetics — role of RET/PTC and BRAF in tumor initiation. J Clin Endocrinol Metab. 2004;89:4280−4284.
- Gupta-AbramsonV, Troxel A, Nellore A, et al. Phase II trial of sorafenib in advanced thyroid cancer. J Clin Oncol. 2008:26:4714−4719.
- Gharib H, Papini E, Paschke R, Duick DS, Valcavi R, Hegedüs L, Vitti P; AACE/AME/ETA Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association Medical Guidelines for Clinical Practice for the Diagnosis and Management of Thyroid Nodules. Endocr Pract. 2010 May-Jun;16 Suppl 1:1-43.
- Ho AL, Grewal RK, Leboeuf R, et al. Selumetinib-enhanced radioiodine uptake in advanced thyroid cancer. N Engl J Med. 2013 Feb 14;368(7):623-32.
- Kloos RT, Ringel MD, Knopp MV, et al. Phase II trial of sorafenib in metastatic thyroid cancer. J Clin Oncol. 2009;27:1675−1684.
- Kurzrock R, Sherman SI, Ball DW, et al. Activity of XL184 (cabozantinib), an oral tyrosine kinase inhibitor, in patients with medullary thyroid cancer. J Clin Oncol. 2011:29:2660-2666.
- Kushi LH, Doyle C, McCullough M, Rock CL, Demark-Wahnefried W, Bandera EV, Gapstur S, Patel AV, Andrews K, Gansler T; American Cancer Society 2010 Nutrition and Physical Activity Guidelines Advisory Committee. American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity. CA Cancer J Clin. 2012 Jan-Feb;62(1):30-67.
- Leboulleux S, Bastholt L, Krause T, et al. Vandetanib in locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 2 trial. Lancet Oncol. 2012 Sep;13(9):897-905. Epub 2012 Aug 14.
- National Cancer Institute. Physician Data Query (PDQ). Thyroid Cancer Treatment. 6/17/2015. Accessed at www.cancer.gov/cancertopics/pdq/treatment/thyroid/healthprofessional on January 20, 2016.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Thyroid Carcinoma. V.2.2015. Accessed at www.nccn.org/professionals/physician_gls/pdf/thyroid.pdf on January 20, 2016.
- Online Mendelian Inheritance in Man, OMIM®. Johns Hopkins University, Baltimore, MD. MIM Number 188550. 8/8/2013. Accessed at http://omim.org/entry/188550 on January 10, 2014.
- Perie S, Garrel R. Pathologies chirurgicales de la glande thyroïde. Societe Francaise de ORL-CFC. 2012.
- Ronckers CM, McCarron P, Engels EA, Ron E. New Malignancies Following Cancer of the Thyroid and Other Endocrine Glands. In: Curtis RE, Freedman DM, Ron E, Ries LAG.
- Hacker DG, Edwards BK, Tucker MA, Fraumeni JF Jr. (eds). New Malignancies Among Cancer Survivors: SEER Cancer Registries, 1973-2000. National Cancer Institute. NIH Publ. No. 05-5302. Bethesda, MD, 2006. Accessed on 4/18/2014 athttp://seer.cancer.gov/archive/publications/mpmono/MPMonograph_complete.pdf.
- Savvides P, Nagaiah G, Lavertu P, Fu P, Wright JJ, Chapman R, Wasman J, Dowlati A, Remick SC. Phase II trial of sorafenib in patients with advanced anaplastic carcinoma of the thyroid. Thyroid. 2013 May;23(5):600-4. Epub 2013 Apr 18.
- Sherman SI, Wirth LJ, Droz J-P, et al. Motesanib diphosphate in progressive differentiated thyroid cancer. N Engl J Med. 2008;359:31−42
- Schlumberger M, Tahara M, Wirth LJ, et al. Lenvatinib versus placebo in radioiodinerefractory thyroid cancer. N Engl J Med. 2015 Feb12;372(7):621-30.
- Schlumberger MJ, Elisei R, Bastholt L, et al. Phase II study of safety and efficacy of motesanib in patients with progressive or symptomatic, advanced or metastatic medullary thyroid cancer. J Clin Oncol. 2009;27:3794−3801.
- Schneider DF, Mazeh H, Lubner SJ, Jaume JC, Chen H. Cancer of the endocrine system. In: Niederhuber JE, Armitage JO, Doroshow JH, Kastan MB, Tepper JE, eds. Abeloff's Clinical Oncology. 5th ed. Philadelphia, Pa: Elsevier; 2014:1112−1142.
- Schneider TC, Abdulrahman RM, Corssmit EP, Morreau H, Smit JW, Kapiteijn E. Longterm analysis of the efficacy and tolerability of sorafenib in advanced radio-iodine refractory differentiated thyroid carcinoma: final results of a phase II trial. Eur J Endocrinol. 2012 Nov;167(5):643-50. Epub 2012 Aug 23.
- Smallridge RC, Copland JA, Brose MS, et al. Efatutazone, an oral PPAR-γ agonist, in combination with paclitaxel in anaplastic thyroid cancer: results of a multicenter phase 1 trial. J Clin Endocrinol Metab. 2013 Jun;98(6):2392-400. Epub 2013 Apr 15.
- Vaisman A, Orlov S, Yip J, et al. Application of post-surgical stimulated thyroglobulin for radioiodine remnant ablation selection in low-risk papillary thyroid carcinoma. Head Neck. 2010;32:689−698.
 Pasar al contenido principal
Pasar al contenido principal