Los tumores nasosinusales benignos no son frecuentes y presentan una incidencia variable en función del tipo histológico.
Según la 4º edición de la Clasificación de los Tumores de Cabeza y Cuello de la Organización Mundial de la Salud (OMS), se podrían agrupar en:
- Tumores de desarrollo embrionario
- Tumores inflamatorios
- Tumores epiteliales
- Tumores no epiteliales
- Tumores mesenquimales
- Tumores neurales
- Tumores odontogénicos
- Tumores fibrogénicos
- Tumores vasculares
Esta clasificación abarca un gran número de tumores benignos nasosinusales, pero nos centraremos en el papiloma invertido, osteomas, angiofibroma juvenil, displasia fibrosa y fibroma osificante.
Estos tumores no tienen una etiología clara, pero se han identificado receptores hormonales que podrían sugerir una etiología hormonal o genética en el caso del angiofibroma juvenil o de la displasia fibrosa, que se asocia a mutaciones del gen GNAS1 en el cromosoma 20, que determina un aumento de la producción de cAMP en las células con mutación perjudicando la capacidad de las células osteoblásticas su diferenciación completa.
Los osteomas se relacionan con alteraciones del desarrollo embrionario o infecciones, además de posibles traumatismos previos, al igual que el fibroma osificante, donde parece tener tener mayor relevancia la teoría del tumor, que defiende que la enfermedad deriva de la nueva producción de tejido óseo y los traumatismos serían solo factores predisponentes.
El factor de riesgo más conocido en el caso del papiloma invertido es la infección de la mucosa nasal por el virus del papiloma humano (VPH-6, 11, 16 y 18), aunque hay otros riesgos asociados como el tabaco o factores genéticos
El tumor benigno nasosinusal más frecuente es el osteoma y suele encontrarse de forma casual en estudios radiográficos, localizándose frecuentemente en el seno frontal. Presentan un lento crecimiento, por lo que rara vez son sintomáticos.
Dentro de los papilomas intranasales, el papiloma invertido es el más frecuente y representativo, con una incidencia de 0.5-1.5 casos por 100 mil habitantes. Tiene su origen en el espacio cilíndrico pseudoestratificado derivado de la membrana ectodérmica scheiderina de la cavidad nasal con patrón de crecimiento hacia el interior, otorgándole de este modo su nombre.
Habitualmente es unilateral, de crecimiento expansivo y con tendencia a la recidiva, en torno a l 12-15%. Presentan riesgo de malignizacion en torno al 8-9%.
Tanto los osteomas como los papilomas invertidos, tienen predominio masculino y en la 4-5 década de la vida; en pacientes fundamentalmente varones, pero más jóvenes que los anteriores, suele presentarse el angiofibroma juvenil, con edades comprendidas entre los 9 y los 20 años, que supone un 0,005% de todos los tumores de cabeza y cuello.
Se trata de un tumor vascular, con comportamiento localmente agresivo que se origina en el tercio posterior de la fosa nasal, a nivel del agujero esfenopalatino, pudiéndose extender hacia la nasofaringe, la órbita, los senos paranasales o la base del cráneo.
De predominio también en la juventud, pero más frecuente en el sexo femenino, se desarrolla la displasia fibrosa, basada en una alteración en la detención del desarrollo óseo sobre todo a nivel del seno maxilar y del seno frontal.
El fibroma osificante se presenta en una población joven, rara vez en pacientes de más de 40 años y en el 70% de los casos, se localiza en el maxilar superior y la mandíbula, siendo rara su aparición en etmoides y órbita.
La clínica es variable y suele consistir en obstrucción nasal, rinorrea, acompañados de algias faciales y epistaxis, en especial en los papilomas invertidos y angiofibromas juveniles, que suele ser unilateral y recurrente en el 45-60% de los casos.
Sin embargo, en función de la extensión del angiofibroma juvenil, podría debutar con una clínica más florida presentándose ya en estadios avanzados. En su crecimiento invade cavidades paranasales, orofaringe, la fosa infratemporal y el pterigomaxilar por continuidad a través del ostium, la órbita por medio de las fisuras orbitarias, y la base craneal media, llegando a comprometer el seno cavernoso, el quiasma óptico y la hipófisis, dando lugar a disminución de la agudeza visual, limitación de los movimientos oculares o exoftalmos. Menos frecuentes serían las acontecidas por invasión intracraneal.
Tanto los osetomas como el fibroma osificante, son en su mayoría asintomáticos, y en el caso de producir síntomas (inferior al 10% de los casos) consistiría en cefaleas, algias faciales u otro tipo de clínica por compresión.
Aunque la displasia fibrosa también tiene un crecimiento lento, suele debutar como una deformidad estética con asimétrica facial, en la mayor parte de los casos indolora. Tiene un porcentaje de malignización bajo, en torno al 0,5-4%.
Las pruebas de imágen como la TC son útiles en el diagnóstico, extensión y resecabilidad del tumor.
- En el papiloma invertido, podremos observar zonas de erosión de la cortical ósea o engrosamiento de la misma, normalmente asociado al lugar de implantación. En algunos casos pueden observarse calcificaciones en el interior de la masa.
Imágen 1: Corte coronal de TC de lesión nodular con base de implantación en seno frontal derecho, obliterándolo por completo compatible con papiloma invertido.
Imágen 2: Corte coronal de TC, donde se observa la misma lesión que destruye el proceso uncinado y se extiende al seno maxilar derecho con ocupación total del mismo.
- La RM nos permite ver los tejidos blandos circundantes y diferenciar el tumor de las secreciones retenidas.
Imágen 4: Corte coronal de RM en T2 donde se observa la masa intranasal derecha previa, con aspecto "cerebriforme" con señal heterogénea en secuencias de potenciación T1 y T2.
Imágen 5: Corte coronal de RM en T1 donde se observa la masa intranasal derecha previa, con aspecto "cerebriforme" con señal heterogénea en secuencias de potenciación T1 y T2.
- En la displasia fibrosa veremos una lesión principalmente esclerosa con conservación de las corticales y espacio medular en “vidrio deslustrado”.
Imágen 6: Corte coronal de TC. Se observa aumento de tamaño y densidad de hueso frontal en línea media, que continúa por la raiz nasal del frontal con contenido "en vidrio deslustrado" y agenesia de seno frontal derecho, compatible con displasia fibrosa.
Imágen 7: Corte axial de TC. Se observa como la lesión compatible con displasia fibrosa, prosigue hacia atrás por la lámina cribosa, de forma bilateral y dominancia derecha, bloqueando alguna de las celdillas etmoidales anteriores.
Imágen 8: Corte sagital de TC, en el que se observa la lesión "en vidreo deslustrado" sin distinción entre la tabla interna y tabla externa.
- El fibroma osificante tiene una imagen típica en “cáscara de huevo”, con un borde óseo adelgazado que rodea un área lítica.
Imágen 9: Corte coronal de TC. Tumoración en meato medio izquierdo, que desplaza medianamente el cornete medio, sin signos de invasión. Lateralmente contacta con proceso uncinado, con afectación del complejo infundibular de drenaje presentando un seno maxilar izquierdo completamente ocupado.
Imágen 10: Corte axial de TC de la tumoración con dimensiones de 45mm anteroposterior a lo largo del meato medio izquierdo.
Imágen 11: Corte sagital de TC de tumoración en meato medio izquierdo.
- La angiografía, angioRM o el TC con contraste intravenoso son de ayuda para el diagnóstico diferencial del angiofibroma juvenil y la biopsia en estos casos estaría contraindicada por el alto riesgo de sangrado.
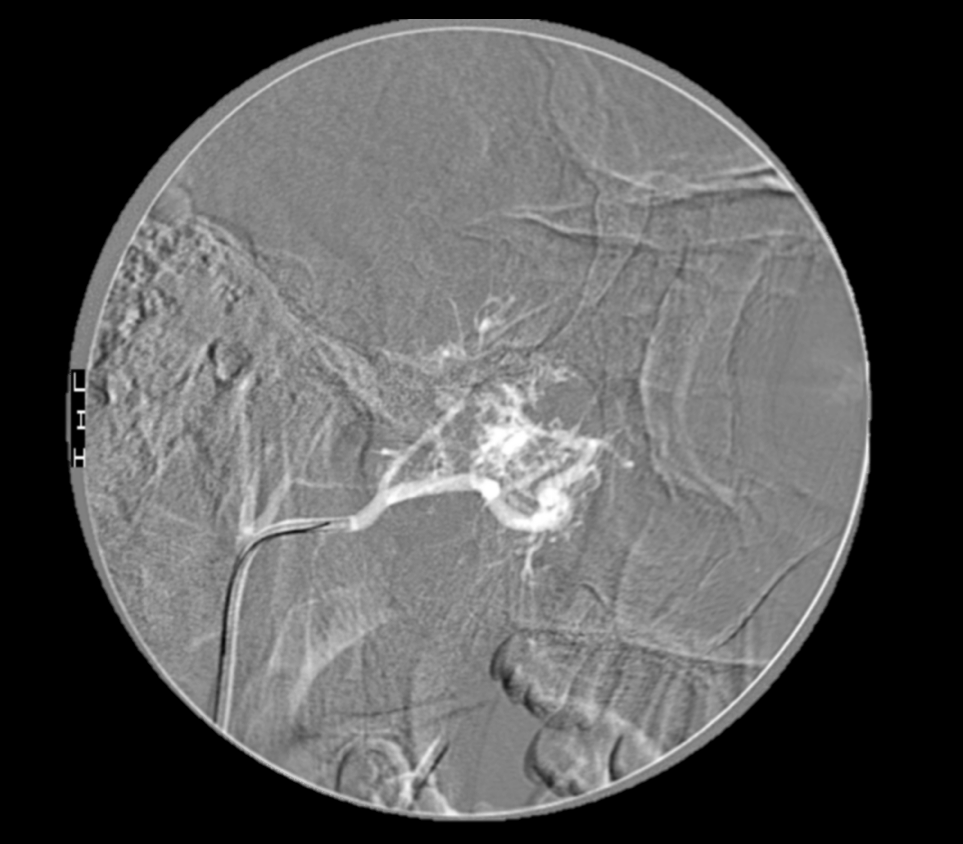
Imágen 12: Captura de arteriografía en la que se comprueba la existencia de una masa altamente vascularizada, que presenta tres aportes arteriales principales. Dichos aportes se corresponden con arteria esfenopalatina derecha, rama meníngea anterior de arteria meníngea media derecha y tronco inferolateral de ACI derecha a nivel paraclinoideo.
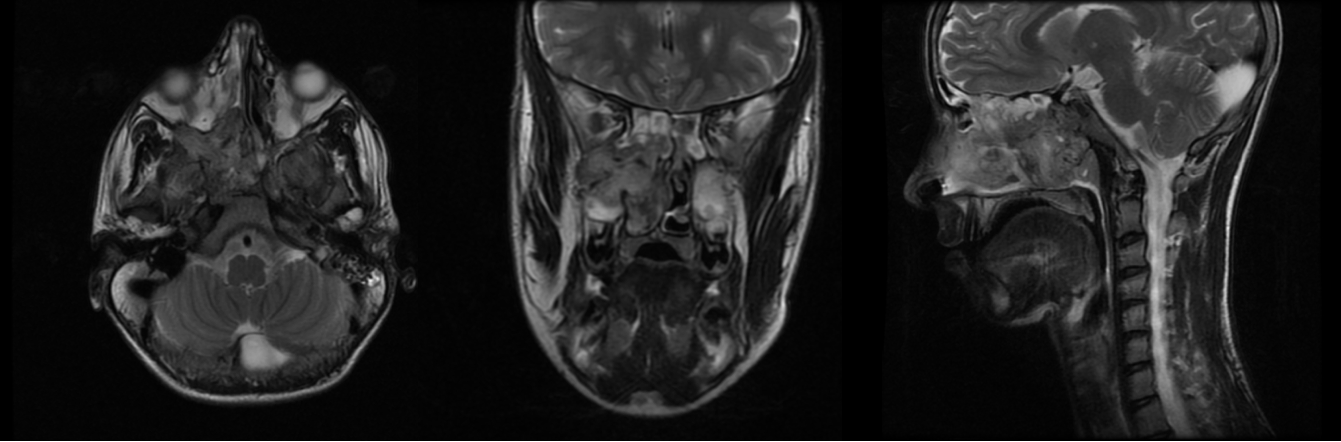
Imágen 13: Corte axial, coronal y sagital (de izquierda a derecha) de RM potenciada en T2, en el que se observa masa, compatible con angiofibroma nasal, que ocupa fosa nasal derecha y abomba hacia coana con morfología polilobulada.
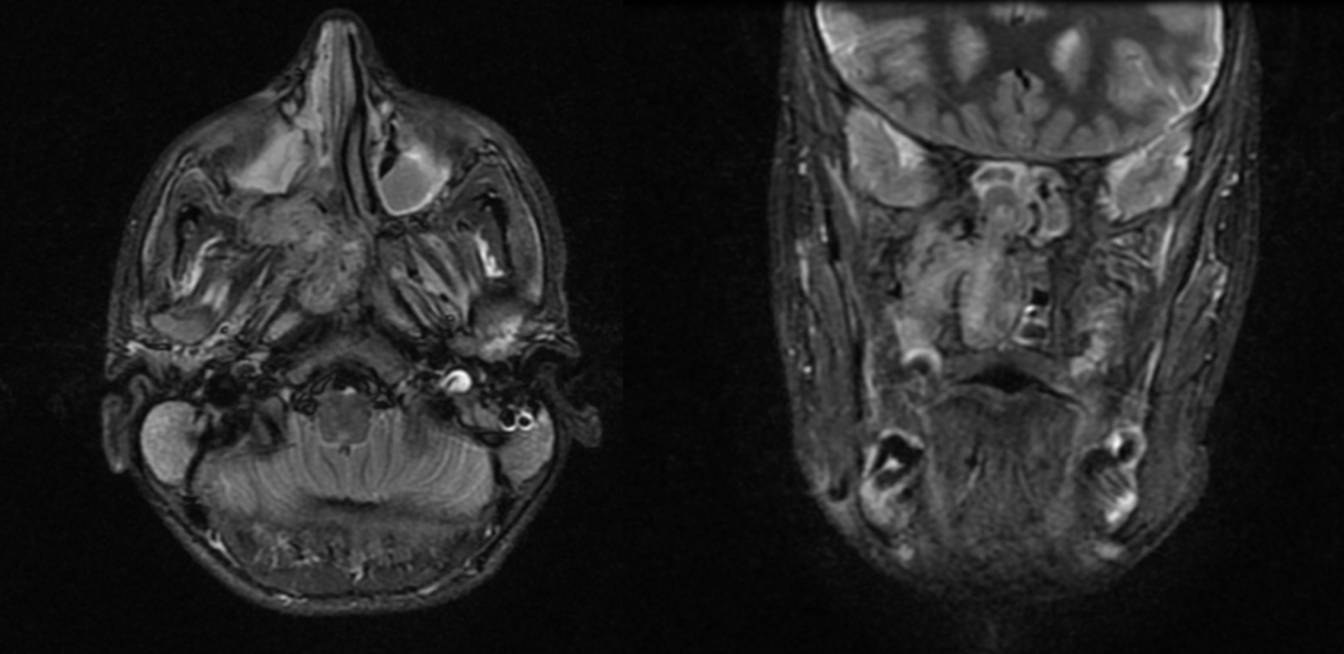
Imágen 14: Corte axial (izquierda) y coronal (derecha) de RM en secuencia STIR, en el que se observa masa, compatible con angiofibroma nasal, que ocupa fosa nasal derecha y abomba hacia coana con morfología polilobulada.
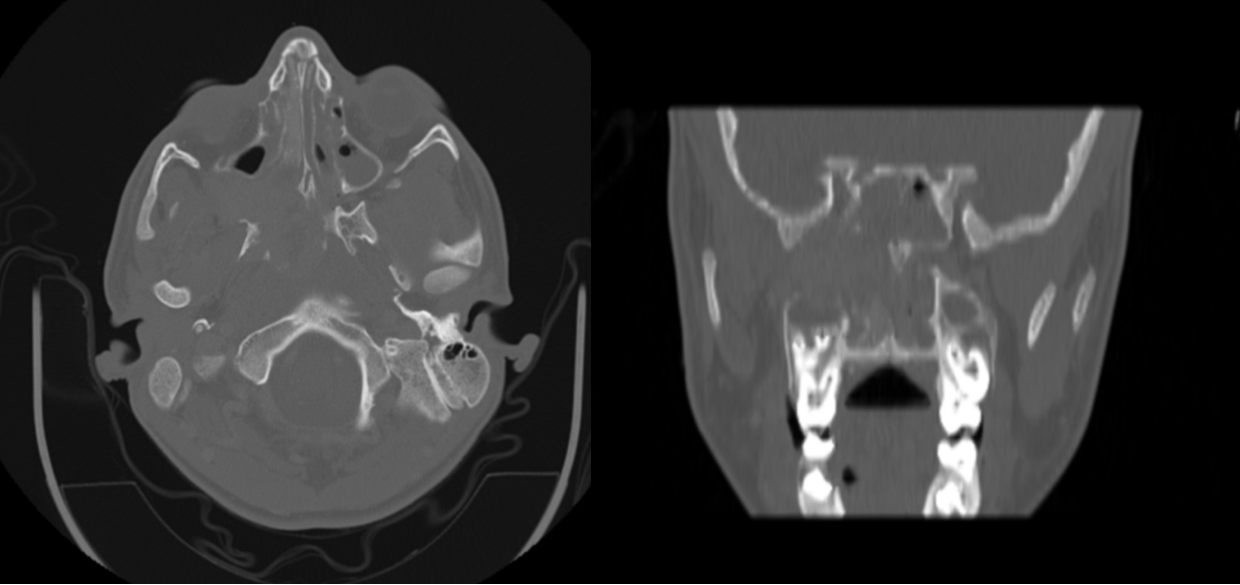
Imágen 15: Corte axial (izquierda) y coronal (derecha), en el que se observa masa, compatible con angiofibroma, que presenta una importante expansión del foramen esfenopalatino derecho con erosiones óseas, extendiéndose lateralmente a fosa pterigopalatina, e improntando la pared posterior del seno maxilar que aparece adelgazada. Posteriormente ocupa el techo nasofaríngeo hasta erosionar el suelo del seno esfenoidal derecho e introducirse en el mismo.
- La TC es el gold standard para el diagnóstico de osteomas, visualizándose normalmente una lesión ósea bien definida que crece en la superficie cortical.
Imágen 16: Corte axial de TC, donde se observa una lesión ósea bien definida compatible con osteoma de grandes dimensiones en seno frontal derecho.
Imágen 17: Corte coronal de TC, en el que se observa la extensión del osteoma en la práctica totalidad del seno frontal derecho.
Imágen 18: Corte sagital de TC de lesión compatible con osteoma de seno frontal derecho.
El diagnóstico es histológico en el caso del papiloma invertido, el fibroma osificante o la displasia fibrosa.
El tratamiento dependerá del tipo histológico, la localización y la extensión del tumor.
Se optará por un tratamiento conservador en los osteomas y la displasia fibrosa siempre y cuando sean asintomáticos. En caso de presentar sintomatología, se llevará a cabo una remodelación, prefiriendo un abordaje endoscópico siempre que permita su resecabilidad. En el fibroma osificante, se recomienda una resección completa ya que la tasa de crecimiento puede ser impredecible.
El tratamiento será quirúrgico en el caso del papiloma invertido, aunque no hay unanimidad en la elección del procedimiento. Sin embargo en el meta-análisis de Busquets et al en el 2006, ya se vieron tasas de recurrencia significativamente más bajas en la resección endoscópica frente a la no endoscópica. Actualmente el abordaje endoscópico sería la técnica de elección, pudiéndose complementar con la técnica abierta en casos de tumores inabarcables mediante endoscopia. El objetivo es la exéresis tumoral, junto con la mucosa adyacente y fresado del lugar de implantación.
La cirugía del angiofibroma juvenil tiene como dificultad añadida la tendencia al sangrado por la irrigación vascular de la arteria esfenopalatina por lo que habría que valorar la embolización prequirúrgica tumoral para reducir el riesgo de sangrado de 24 a 48 horas hasta 3 a 7 días previo a la cirugía, sopesando el riesgo de complicaciones que esta acarrea. Para estadios iniciales, la técnica endosópica sería la idónea ya que es menos cruenta, pero en estadios avanzados, se deberá valorar la exposición y kla resecabilidad a la hora de elegir la técnica más apropiada. La radioterapia se limitaría a enfermedad residual postcirugía o enfermedad no resecable quirúrgicamente. Tiene una tasa de recurrencia en torno al 6-7% para estadios iniciales, aumentando al 40-50% en estadios más avanzados.
Como nombrábamos anteriormente, en el caso de los papilomas invertidos tienen una alta tasa de recurrencia, en torno al 15%, que junto con la tasa de malignización del 10%, a pesar del tratamiento quirúrgico, deberemos hacer un seguimiento y control posterior en consulta.
También presenta una tasa de recurrencia importante el angiofibroma juvenil, siendo en torno al 6-7% para estadios iniciales, aumentando al 40-50% en estadios más avanzados.
Además deberemos hacer seguimiento de los pacientes con displasia fibrosa, dado su riesgo de malignización.
Las complicaciones pueden ser las relacionadas con el crecimiento del propio tumor como compresión de estructuras adyacentes u obstrucción del drenaje de los senos ocasionando cuadros de sinusitis o mucoceles; o también las ocasionadas por la cirugía de senos paranasales que varían en función de la localización y extensión tumoral.
- Thompson LDR, Franchi A. New tumor entities in the 4th edition of the World Health Organization classification of head and neck tumors: Nasal cavity, paranasal sinuses and skull base. Virchows Arc Int J Pathol 2018;472: 315-30
- Busquets JM, Hwang PH. Endoscopic resection of sinonasal inverted papilloma: a metaanalysis. Otolaryngol Head Neck Surg. 2006;134: 476-482
- Llorente Pendás JL, Suárez Fente V, Suárz Nieto C. Papilomas invertidos nasosinusales. Acta Otorrinolaringológica Esp 2007;58:78-83
- Mena F, Mena C, Quiroz J.V. Cirugía en el papiloma invertido nasal. Rev Otorrinolarigol Cir Cabeza Cuello 2010; 70:43-48
- Phillips PP, Gustafson RO, Facer GW. The clinical behavior of inverting papilloma of the nose and paranasal sinuses: report of 112 cases and review of the literature. Laryngoscope 1990;100(5):463-9
- Lawson W, Patel ZM. The evolution of management for inverted papilloma: an analysis of 200 cases. Otolaryngology – Head & Neck Surgery 2009;140(3):330-5
- Sham et al. A case-control study of the risk factors associated with sinonasal inverted papilloma. Am J Rhinol Allergy. 2010 Jan-Feb;24(1):e37-40
- Goudakos J.K, Blioskas S, Vlachtsis K, Markou K.D. Endoscopic Resection of Sinonasal Inverted Papillomas: Systematuc Review and Meta-Analysis. American Journal of Rhinology & Allergy. 2018;32(3):167-174
- Ferreira Sbrana M, Rafael Borges R. F, De Rezende inna F, Brandao Neto D, Louis Voegel R. Sinonasal inverted papilloma: rate of recurrene and malignant transformation in 44 operated patients. Brazilian Journal of Otorhinolaryngology. 2021;87:80-84
- Nakayama T, Tsunemi Y, Kashiwagi T, Kuboki A, Yamakawa S, Konno W, Mori A, Limura J, Tsukidate T, Tanaka Y, Haruna S. Comparision of current staging systems for sinonasal inverted papilloma. American Journal of Rhinology & Allergy. 2021;35(1):64-71
- Coutinho G, Marques J, Leal M, Spratley J, Sá Fernandez M, Santos M. Surgical outcomes of sinonasal inverted papilloma: a 17 year review. Braz J Otorhinolaryngol. 2020; 86(3):315-320
- Peng R, Thamboo A, Choby G, Ma Y, Zhou B, Hwang P.H. Outcomes of sinonasal inverted papiloma resection by surgical approach: an updated systematic review and meta-analysis. International Forum of Allergy & Rhinology. 2019. 9(6):573-581
- Arslan HH, Tasli H, Cebeci S, Gerek M. The Management of the Paranasal Sinus Osteomas. J Craniofac Surg. 2017 May;28(3):741-745.
- Georgalas C, Goudakos J, Fokkens WJ. Osteoma of the skull base and sinuses. Otolaryngol Clin North Am. 2011 Aug;44(4):875-90.
- Castelnuovo P, Valentini V, Giovannetti F, Bignami M, Cassoni A, Iannetti G. Osteomas of the maxilofacial district: endoscopic surgery vs open surgery. J Craniofac Surg 2008 ;19:1446-52
- Seiberling K, Floreani S, Robinson S, Wormald PJ. Endoscopic management of frontal sinus osteomas revisited. Am J Rhinol Allergy. 2009 May-Jun;23(3):331-6.
- Hania M, Sharif MO. Maxillary sinus osteoma: A case report and literature review. J Orthod. 2020 Sep;47(3):240-244.
- Karunaratne YG, Gunaratne DA, Floros P, Wong EH, Singh NP. Frontal Sinus Osteoma: From Direct Excision to Endoscopic Removal. J Craniofac Surg. 2019 Sep;30(6):e494.
- López F, Triantafyllou A, Snyderman CH, Hunt JL, Suárez C, Lund VJ, Strojan P, Saba NF, Nixon IJ, Devaney KO, Alobid I, Bernal-Sprekelsen M, Hanna EY, Rinaldo A, Ferlito A. Nasal juvenile angiofibroma: Current perspectives with emphasis on management. Head Neck. 2017 May;39(5):1033-1045.
- Bertazzoni G, Schreiber A, Ferrari M, Nicolai P. Contemporary management of juvenile angiofibroma. Curr Opin Otolaryngol Head Neck Surg. 2019 Feb;27(1):47-53..
- Bakshi SS, Bhattacharjee S. Juvenile Nasopharyngeal Angiofibroma. J Pediatr Hematol Oncol. 2016 Aug;38(6):491-2.
- Boghani Z, Husain Q, Kanumuri VV, Khan MN, Sangvhi S, Liu JK, Eloy JA. Juvenile nasopharyngeal angiofibroma: a systematic review and comparison of endoscopic, endoscopic-assisted, and open resection in 1047 cases. Laryngoscope. 2013 Apr;123(4):859-69.
- Oré Acevedo JF, La Torre Caballero LM, Urteaga Quiroga RJ. Juvenile nasopharyngeal angiofibroma surgical treatment in paediatric patients. Acta Otorrinolaringol Esp (Engl Ed). 2019 Sep-Oct;70(5):279-285.
- DiCaprio MR, Enneking WF. Fibrous dysplasia. Pathophysiology, evaluation, and treatment. J Bone Joint Surg Am. 2005 Aug;87(8):1848-64.
- Florez H, Peris P, Guañabens N. Fibrous dysplasia. Clinical review and therapeutic management. Med Clin (Barc). 2016 Dec 16;147(12):547-553.
- Ricalde P, Magliocca KR, Lee JS. Craniofacial fibrous dysplasia. Oral Maxillofac Surg Clin North Am. 2012 Aug;24(3):427-41.
- Feller L, Wood NH, Khammissa RA, Lemmer J, Raubenheimer EJ. The nature of fibrous dysplasia. Head Face Med. 2009 Nov 9;5:22.
- Manes RP, Ryan MW, Batra PS, Mendelsohn D, Fang YV, Marple BF. Ossifying fibroma of the nose and paranasal sinuses. Int Forum Allergy Rhinol. 2013 Feb;3(2):161-8.
- Jurlina M, Skitarelić N, Passali D, Passali FM, Mladina R. Endonasal endoscopic resection of ossifying fibroma involving the ethmoid sinus, orbit and anterior skull base: case report and literature review. Acta Otorhinolaryngol Ital. 2016 Apr;36(2):144-8.
- Sun N, Xu WH, Cao LH, Zhao XY, Zhang JF, Li J, Li WP, Sun GB. A case of ossifying fibroma of the frontal sinus. Exp Ther Med. 2013 May;5(5):1359-1362.
- Zhang X, Pang W, Jiang Y, Chen X, Zhang M, Li N, Yan X, Chen M, Ju J. [Clinical characteristics and surgical treatment analysis of paranasal ossifying fibroma]. Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2020 Apr;34(4):351-355.
 Pasar al contenido principal
Pasar al contenido principal