Introducción
- La neuromonitorización intraoperatoria (NMIO) en la cirugía tiroidea y paratiroidea (CTPT) permite evaluar el estado funcional de los nervios laríngeos, ayuda en su identificación y disección —principalmente el nervio laríngeo recurrente (NLR)— con una precisión global del 99,26%, valor predictivo positivo del 78,38% y valor predictivo negativo del 99,85%) (Calò et al., 2016).
- La mayoría de la literatura se refiere a la aplicación de NMIO intermitente en en NLR en la cirugía de tiroides lo que plantea algunas limitaciones en la investigación bibliográfica. La aplicación de la NMIO en cirugía de paratiroides (asociada o no a cirugía de tiroides) sigue, en general, los criterios aplicados a la cirugía de tiroides.
- El uso del NMIO en la CTPT sigue provocando controversia pese a su amplia implantación y a la falta de una reducción significativa de la parálisis posoperatoria uni o bilateral del NLR.
- En 2018 la Sociedad Española de Otorrinolaringología y Cirugía de Cabeza y Cuello, publicó un documento con recomendaciones para guiar su uso en cirugía de tiroides y paratiroides centrado en siete puntos cuya lectura recomendamos (Pardal et al., 2017):
1. Indicaciones
2. Equipo
3. Técnica, parámetros de programación y registro
4. Conducta en pérdida de señal
5. Laringoscopia
6. Voz
7. Implicaciones legales y éticas
Objetivo
En este capítulo ofreceremos algunos puntos clave para la aplicación de la NMIO en CTPT, principalmente NMIO intermitente aplicada al NLR (y, por lo general, en cirugía de tiroides).
Conceptos clave en neuromonitorización intraoperatoria (NMIO) en cirugía de tiroides y paratiroides (CTPT)
¿Qué es la NMIO?
Es el registro de la actividad neuromuscular de los músculos intrínsecos de la laringe (tiroaritenoideo/ interaritenoideo) tras el estímulo con corriente eléctrica de uno de sus nervios motores (nervio laríngeo recurrente -NLR-, nervio vago -NV- o sobre el nervio laríngeo superior -NLS- recogiendo la actividad del músculo cricotiroideo). El estímulo y la señal obtenida sobre el NLR se denomina R, sobre el NV se denomina V y sobre el NLS se denomina S (para la señal inicial se añade el número 1 -R1, V1, S1- y la final el número 2 -R2, V2, S2-).
¿Qué espera el profesional?
- Ayuda en la localización, identificación y disección del NLR
- Ayuda a localizar el punto de lesión del NLR
- Informa sobre la funcionalidad del NLR al finalizar la cirugía
- Ayuda a tomar decisiones durante la cirugía bilateral en caso de pérdida de señal en el primer lado o con parálisis previa contralateral
- Reduce la incidencia de parálisis bilateral del NLR
- Aumenta la seguridad del paciente
- Aumenta la confianza del cirujano
- Docencia
- Medicolegal
Tipos de NMIO
Según el tipo de estímulo: NMIO intermitente (el cirujano aplica el electrodo de estimulación monopolar o bipolar sobre el nervio que desea testar y recoge una respuesta) o NMIO continua (mediante un electrodo fijo colocado sobre el NV que manda estímulos en pulsos (10 estímulos/s de 100 ms de duración) se registra la actividad neuromuscular de forma continua (esta también puede obtenerse provocando el reflejo aductor laríngeo).
Según el electrodo de registro: electrodos de aguja insertados los músculos tiroaritenoideos a través de la membrana cricotiroidea denominada NMIO translaríngea (TL), estos electrodos pueden ser individuales o pareados) o electrodos de superficie en el tubo endoctraqueal (TET) (Pardal et al., 2013).
Según el nervio estimulado: NLR -señal R- (músculos tiroaritenoideo / interaritenoideo), NV -señal V- o NLS -señal S- (músculo cricotiroideo) (Randolph et al., 2011).
Componentes del sistema de NMIO
Los sistemas comercializados tienen unos componentes comunes: conexión eléctrica, monitor –donde se programan los parámetros de registro y estímulo-, la caja de conexión –para conectar el sistema neuromuscular del paciente con el monitor mediante electrodos de registro –de aguja insertados en los músculos tiroaritenoideos a través de la membrana cricotiroidea o de superficie adheridos al tubo endotraqueal y que están en contacto con las cuerdas vocales -, los electrodos de tierra (verde) y retorno (rojo) y los electrodos de estimulación (que puede ser manejado por el cirujano en el caso de la monitorización intermitente o estar fijado en el nervio vago en el caso de la monitorización continua. El registro continuo del reflejo aductor laríngeo es una modalidad de monitorización continua actualmente en desarrollo.
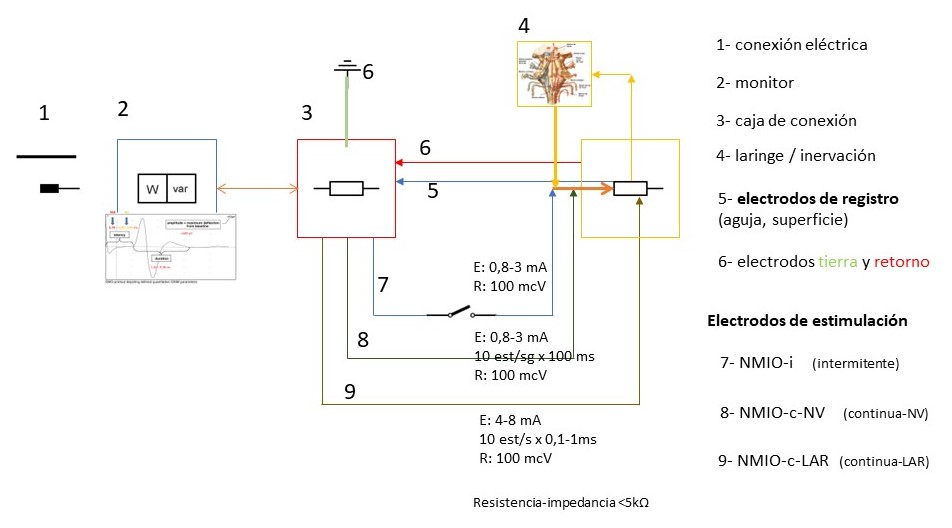
Figura 1. Componentes de los sistemas de NMIO en CTPT. Componentes: 1- conexión eléctrica, 2- monitor, 3- caja de conexión, 4- sistema neuromuscular, 5- electrodos de registro (que pueden ser de aguja o de superficie adheridos al tubo endotraqueal) y 6- electrodos de tierra y retorno. Tipos de NMIO según el electrodo de estimulación: 7- NMIO-i intermitente, 8- NMIO-c-NV continua con electrodo de estimulación continua en nervio vago y 9- NMIO-c-LAR continua con electrodo de estimulación endolaríngeo homolateral para inducir el reflejo aductor laríngeo (LAR). En el sistema NMIO-i el circuito se cierra cuando se aplica el electrodo de estimulación (sobre un nervio o en su cercanía o alejado del nervio) obteniéndose una señal o ausencia de ella). En los sistemas de NMIO-c el electrodo de estimulación está fijo sobre el NV o sobre la laringe y aplica de forma cíclica un estímulo por lo que el ciruito está cerrado y recoge las modicifaciones de la actividad neuromuscular (señal normal o reducción de la señal con incremento de la latencia, reducción de la intensidad/aplitud de la onda o ausencia de señal).
Programación del monitor
Los valores estándar que se programan en el monitor son (Randolph et al., 2011):
- Estímulo: 0,8-3 mA. Generalmente de 0,8 a 1 mA. Sobre el NV o para mapear puede aumentarse hasta 3 mA.
- Umbral de evento: 100 µV. Este es el umbral a partir del cual puede obtenerse una respuesta.
- Resistencia de los electrodos: <5 KΩ (<0,5kOhm). Esta medición la realiza el sistema automáticamente. Si a impedancia es mayor de la programada el sistema no funciona.
Cuando aparecen interferencias puede elevarse el umbral para mitigarlas. Y a la inversa, si hay dificultad para obtener respuesta puede bajarse el umbral de eventos (y aumentar la intensidad del estímulo).
Otros parámetros como son la amplitud o la latencia pueden ser también modificados según las preferencias del cirujano.
Aplicación técnica
Los cuatros puntos clave para la correcta interpretación de la NMIO son (Randolph et al., 2011; Pardal et al., 2018):
Pérdida de señal
Se entiende por pérdida de señal cuando tras haber tenido previamente señal de NMIO (Randolph et al., 2011):
Comprobación en caso de pérdida de señal
En caso de pérdida de señal deben hacerse las siguientes comprobaciones (Randolph et al., 2011; Pardal et al., 2018; Estébanez et al, 2022)
Conducta en caso de pérdida de señal (Randolph et al., 2011; Pardal et al., 2018)
Cuando realizar NMIO en CTPT
Los grupos de trabajo en NMIO recomiendan su utilización sistemática dado que no siempre es posible predecir el grado de dificultad en el preoperatorio (Randolph et al., 2011; Calò et al., 2016), y al menos en cirugía bilateral, en cirugía de revisión y en casos con parálisis preexistente (Chandrasekhar et al., 2013).
La regla general actualmente es utilizar la NMIO en todos los casos de CTPT (Pardal et al., 2018).
Aspectos éticos y legales (Pardal et al., 2018)
1. Información y consentimiento informado:
- Se debe informar a los pacientes sobre los riesgos individuales de una lesión o disfunción temporal o permanente del nervio laríngeo recurrente (NLR) y del nervio laríngeo superior (NLS), ya sea de forma unilateral, bilateral o combinada, y sobre las consecuencias para las vías respiratorias (obstrucción, traqueotomía), la voz y la deglución.
- Se debe informar al paciente sobre el uso de la NMIO y, si no se va a utilizar, el cirujano debe justificar por qué.
- Si la NMIO se utiliza de forma selectiva, se debe informar al paciente de esta decisión y el cirujano debe poder explicar por qué no la utiliza en todos los casos teniendo en cuenta que las situaciones de riesgo de parálisis no pueden predecirse preoperatoriamente.
- Se debe informar que el uso del NMIO no garantiza la prevención de las lesiones nerviosas.
- Debe informarse que se pueden producir falsos negativos (FN) o positivos (FP) debido a otras variables, como la anestesia o la asistencia técnica.
- Se debe informar a los pacientes sobre la posibilidad de aplazar la segunda lobectomía en una tiroidectomía total planificada si se produce una pérdida de señal en el primer lado operado para evitar una posible parálisis bilateral.
Conclusiones
La neuromonitorización en CTPT:
1- Ayuda en la identificación del NLR.
2- Informa sobre la función del NLR al concluir la cirugía.
3- Permite adoptar distintas estrategias en caso de pérdida de señal en el primer lado operado en cirugía bilateral programada o si existía parálisis contralateral conocida previamente.
4- Ayuda a reducir la probabilidad de parálisis laríngea bilateral. La prevalencia de parálisis laríngea bilateral es menor en las series con neuromonitorización.
5- Debe considerarse la realización de la tiroidectomía total en dos etapas en caso de pérdida de señal en la primera lobectomía.
Calò P.G., Medas F., Gordini L., Podda F., Erdas E., Pisano G, et al. (2016). Interpretation of intraoperative recurrent laryngeal nerve monitoring signals: The importance of a correct standardization. Int J Surg. 28:S54-S58. https://doi.org/10.1016/j.ijsu.2015.12.026
Cavicchi O, Burgio L, Cioccoloni E, Piccin O, Macrì G, Schiavon P, et al. (2018). Intraoperative intermittent neuromonitoring of inferior laryngeal nerve and staged thyroidectomy: our experience. Endocrine [Internet]. 1-6. https://doi.org/10.1007/s12020-018-1739-5
Chandrasekhar SS, Randolph GW, Seidman MD, Rosenfeld RM, Angelos P, Barkmeier-Kraemer J, et al. (2013). Clinical practice guideline: improving voice outcomes after thyroid surgery. Otolaryngol Head Neck Surg. 148(6 Suppl):S1-37. https://doi.org/10.1177/0194599813487302
Chiang F-Y, Lu I-C, Chang P-Y, Dionigi G, Randolph GW, Sun H, et al. (2017). Comparison of EMG signals recorded by surface electrodes on endotracheal tube and thyroid cartilage during monitored thyroidectomy. Kaohsiung J Med Sci [Internet]. 33(10):503-9. https://doi.org/10.1016/j.kjms.2017.06.006
Dionigi G, Dralle H, Liddy W, Kamani D, Kyriazidis N, Randolph GW, et al. (2016). IONM of the Recurrent Laryngeal Nerve. En: Randolph GW (editor). The Recurrent and Superior Laryngeal Nerves. Springer International Publishing Switzerland; p. 147-68. https://doi.org/10.1007/978-3-319-28658-7_9
Estébanez-Peláez G, Pardal-Refoyo JL, González-Sánchez E, Ferreira-Cendón S (2022). Neuromonitorización intraoperatoria y parálisis laríngea bilateral posoperatoria en tiroidectomía total. Revisión sistemática y metanálisis. Rev ORL. 13(4):e28102. https://doi.org/10.14201/orl.28102
Pardal-Refoyo JL (2012). Utilidad de la neuromonitorización en cirugía tiroidea. Acta Otorrinolaringol Esp. 63(5):355-363. doi: https://doi.org/10.1016/j.otorri.2012.03.003
Pardal-Refoyo JL, Cuello-Azcárate JJ, Ochoa-Sangrador C. (2013). Contribución de la neuroestimulación a la seguridad en la extubación traqueal tras tiroidectomía total. Estudio prospectivo con electrodos de aguja. Rev Esp Anestesiol Reanim. 60(10):563-570. doi: https://doi.org/10.1016/j.redar.2013.06.007
Pardal-Refoyo JL, Cuello-Azcárate JJ, Santiago-Peña LF (2014). Diseño de una lista de verificación en la gestión de riesgos en tiroidectomía. Endocrinol Nutr. 61(9):445-454. doi: https://doi.org/10.1016/j.endonu.2014.05.002
Pardal-Refoyo JL, Ochoa-Sangrador C (2016). Lesión bilateral del nervio laríngeo recurrente en tiroidectomía total con o sin neuromonitorización intraoperatoria. Revisión sistemática y metaanálisis. Acta Otorrinolaringol Esp. 67(2):66–74. doi: https://doi.org/10.1016/j.otorri.2015.07.002
Pardal-Refoyo JL, Pardal-Peláez B, Ochoa-Sangrador C, Estévez-Alonso JS (2020). Laryngeal paralysis detected in preoperative laryngoscopy in malignant and benign thyroid disease. Systematic review and meta-analysis. Endocrinol Diabetes Nutr (Engl Ed). 67(6):364-373. https://doi.org/10.1016/j.endinu.2019.09.014
Pardal-Refoyo JL, Parente-Arias P, Arroyo-Domingo MM, Maza-Solano JM, Granell-Navarro J, Martínez-Salazar JM, et al. (2017). Recomendaciones sobre el uso de la neuromonitorización en cirugía de tiroides y paratiroides. Acta Otorrinolaringológica Española. https://doi.org/10.1016/j.otorri.2017.06.002
Pardal-Refoyo JL, Parente-Arias P, Arroyo-Domingo MM, Maza-Solano JM, Granell-Navarro J, Martínez-Salazar JM, et al. (2018). Recommendations on the use of neuromonitoring in thyroid and parathyroid surgery. Acta Otorrinolaringológica Española. https://doi.org/10.1016/j.otorri.2017.06.005
Randolph GW, Dralle H, Abdullah H, Barczynski M, Bellantone R, Brauckhoff M, et al. (2011). Electrophysiologic recurrent laryngeal nerve monitoring during thyroid and parathyroid surgery: international standards guideline statement. Laryngoscope. 121(Suppl):S1-16. https://doi.org/10.1002/lary.21158
Randolph GW. (2016). The Recurrent and Superior Laryngeal Nerves. Springer International Publishing Switzerland; 313 p.
Schneider R, Randolph GW, Dionigi G, Wu CW, Barczynski M, Chiang FY, et al. (2018). International neural monitoring study group guideline 2018 part I: Staging bilateral thyroid surgery with monitoring loss of signal. Laryngoscope. 128(S4):S1-17. https://doi.org/10.1002/lary.27360
Sun H, Tian W, Jiang K, Chiang F, Wang P, Huang T, et al. (2015). Clinical guidelines on intraoperative neuromonitoring during thyroid and parathyroid surgery. Ann Transl Med. 3(15):213. https://doi.org/10.3978/j.issn.2305-5839.2015.09.03
 Pasar al contenido principal
Pasar al contenido principal